题目内容
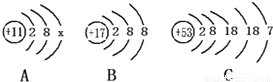
如图为A、B、C三种元素的粒子结构示意图,回答下列问题:(1)若A为原子时,X=______;
(2)B粒子的符号为______,该元素与A元素形成的化合物是由______(填“分子”、“原子”或“离子”)构成的;
(3)日本大地震引发福岛核电站发生核泄漏,我国很多省市都测出微量放射性元素碘-131(相对原子质量为131的碘元素),图中C为碘元素的结构示意图,则碘-131的一个原子中中子数为______;
(4)碘-131在衰变过程中,一部分原子核向外放射β粒子后变成了氙-131(原子序数为54),根据你所学知识思考判断这一过程中发生变化的是______.
A.元素种类 B.原子核内的质子数 C.原子核内的中子数 D.相对原子质量.
【答案】分析:(1)根据原子中核内质子数与核外电子数之间的关系判断X的值;
(2)根据B微粒的质子数与电子数判断微粒的名称,写出符号;根据B元素与A元素的原子结构的特点分析形成的化合物的构成微粒;
(3)根据相对原子质量=质子数+种子数及C微粒的质子数,判断碘-131的一个原子中的中子数;
(4)根据衰变过程中的变化分析有关量的变化.
解答:解:(1)若A为原子时,核内质子数等于核外电子数,则X=1;
(2)B粒子的质子数是17,电子数是18.应为氯离子,符号为:Cl-;由于B元素的原子易形成阴离子,A元素的原子已形成阳离子,所以,A、B元素形成的化合物是离子化合物;
(3)由于相对原子质量=质子数+种子数,碘的质子数是53,所以中子数是:131-53=78;
(4)由于碘-131在衰变过程中,一部分原子核向外放射β粒子后变成了氙-131,元素的种类发生了变化,所以,
元素种类、原子核内的质子数一定发生了变化,由于相对原子质量没有发生变化,中子数一定发生了变化.
故答为:(1)1;(2)Cl-,离子;(3)78;(4)ABC.
点评:掌握原子结构示意图与离子结构示意图的区别、特点;掌握核外电子在化学变化中的作用和得失电子的规律特点.
(2)根据B微粒的质子数与电子数判断微粒的名称,写出符号;根据B元素与A元素的原子结构的特点分析形成的化合物的构成微粒;
(3)根据相对原子质量=质子数+种子数及C微粒的质子数,判断碘-131的一个原子中的中子数;
(4)根据衰变过程中的变化分析有关量的变化.
解答:解:(1)若A为原子时,核内质子数等于核外电子数,则X=1;
(2)B粒子的质子数是17,电子数是18.应为氯离子,符号为:Cl-;由于B元素的原子易形成阴离子,A元素的原子已形成阳离子,所以,A、B元素形成的化合物是离子化合物;
(3)由于相对原子质量=质子数+种子数,碘的质子数是53,所以中子数是:131-53=78;
(4)由于碘-131在衰变过程中,一部分原子核向外放射β粒子后变成了氙-131,元素的种类发生了变化,所以,
元素种类、原子核内的质子数一定发生了变化,由于相对原子质量没有发生变化,中子数一定发生了变化.
故答为:(1)1;(2)Cl-,离子;(3)78;(4)ABC.
点评:掌握原子结构示意图与离子结构示意图的区别、特点;掌握核外电子在化学变化中的作用和得失电子的规律特点.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
 13、(1)用化学用语表示:
13、(1)用化学用语表示: 18、如图为a、b、c三种物质的溶解度曲线,根据曲线回答下列问题.
18、如图为a、b、c三种物质的溶解度曲线,根据曲线回答下列问题. 23、如图为A、B、C三种物质的溶解度曲线.据此回答:
23、如图为A、B、C三种物质的溶解度曲线.据此回答: 如图为A、B、C三种物质的溶解度曲线,据图回答:
如图为A、B、C三种物质的溶解度曲线,据图回答: 如图为A、B、C三种固体物质的溶解度曲线,请回答:
如图为A、B、C三种固体物质的溶解度曲线,请回答: