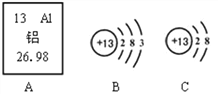
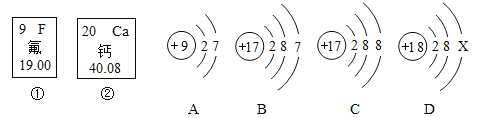
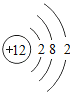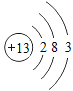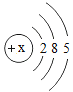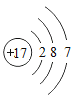题目内容
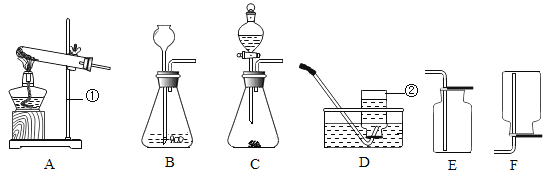
【题目】为了测定某硫酸铜溶液的质量分数,小杨同学取50.0g样品置于烧杯中,逐滴加入氢氧化钠溶液,加入氢氧化钠溶液质量和生成沉淀质量的关系如下图所示。请计算:
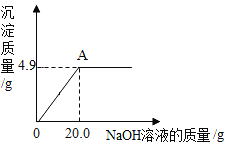
(1)NaOH的相对分子质量_______。
(2)硫酸铜刚好完全反应时,所得溶液的质量_______。
(3)硫酸铜溶液中溶质的质量分数是多少?(写出计算过程)_______
【答案】40 65.1g 16.0%
【解析】
(1)NaOH的相对分子质量为23+16+1=40,故填:40;
(2)所得溶液的质量为50.0g+20.0g-4.9g=65.1g,故填:65.1g;
(3)设样品中硫酸铜的质量为x。
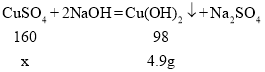
![]()
x=8.0g
硫酸铜溶液中溶质的质量分数为:![]() 。
。
答:硫酸铜溶液中溶质的质量分数为16.0%。

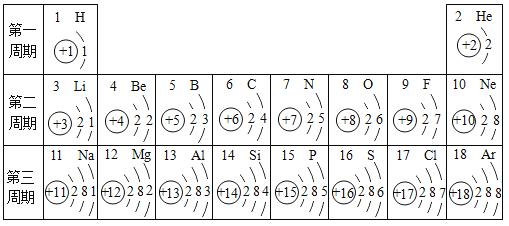
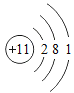
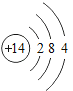
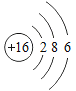
【题目】下表为元素周期表中某一周期元素的原子结构示意图。请回答下列问题:
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
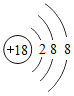
(1)氯离子的结构示意图为_____。
(2)下列说法正确的是_____(填序号)。
A 具有相对稳定结构的原子是氩
B 钠元素与氯元素形成的化合物是由分子直接构成的物质
C 镁离子失去电子形成原子
D 质子数决定元素种类,故质子数相等的微粒,一定是同种元素
(3)上表微粒中,与碳有相似化学性质的元素是_____。
(4)硫和地壳中含量最高的金属元素形成的化合物的化学式是_____。
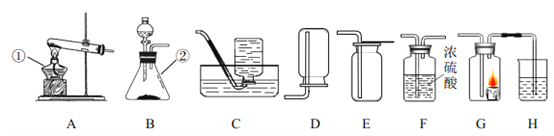
【题目】某化学活动兴趣小组用如图装置进行一氧化碳和氧化铜反应的探究实验反应一段时间后,装置A硬质玻璃管内黑色粉末全部变成红色
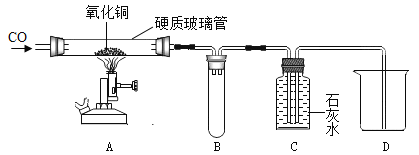
(1)装置A中反应体现了一氧化碳具有___________性(化学性质),写出具有此性质的另外一种物质__________(化学式)。
(2)装置C中现象是有气泡,_______,_______;写出C中发生反应的化学方程式:_______。
(3)停止通入一氧化碳,熄灭A处的火焰,装置B中可能出现的现象是:__________________
(4)有同学认为该装置需要添加尾气处理装置,你认为是否需要______(填“是”或“否”), 请说明理由__________.
(5)同学们通过查阅资料得知:氧化亚铜(Cu2O)和铜均为红色固体,且Cu2O能和稀硫酸反应,反应的化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O.他们对反应后玻璃管中的红色固体进行如下探究:
(提出问题)反应后生成的红色固体成分是什么?
(作出猜想)猜想一:红色固体只有Cu
猜想二:红色固体只有Cu2O
猜想三:红色固体可能含有_____。
(实验探究)设计如下实验方案
实验操作 | 现象 | 结论 |
取少量红色固体于试管中,加入过量的稀硫酸 | ______________________________ | 红色固体含有Cu2O |
(思考与分析)甲同学认为猜想二正确,同学们分析后认为他的结论不准确,理由是________________。为此,同学们补充进行了以下实验:称取mg红色固体于试管中,加入过量的稀硫酸充分反应,然后过滤、洗涤、干燥、称量,得到ng固体。当n>_________(含m的代数式)时,可以得出猜想三的结论正确。