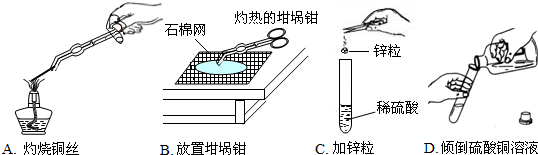
题目内容
金属的化学性质
(1) 与氧气反应____________________________________ ,反应类型( ) 。
(2) 与酸的反应
①( 以铁为例)____________________________________ ,反应类型( ) 。
②与硫酸铜的反应:______________________________ ,反应类型( ) 。
从上述的金属性质中我们可以总结出比较金属活动性强弱的两条规律___________________;____________。
(2) 与酸的反应
①( 以铁为例)____________________________________ ,反应类型( ) 。
②与硫酸铜的反应:______________________________ ,反应类型( ) 。
从上述的金属性质中我们可以总结出比较金属活动性强弱的两条规律___________________;____________。
(1)金属与氧气反应,生成金属氧化物 ; 化合反应
(2)金属与酸反应生成盐和氢气
①Fe+H2SO4====FeSO4+H2↑ ; 置换反应
②CuSO4+Fe====FeSO4+Cu ; 置换反应
1.活泼的金属可以置换出酸中的氢
2.活泼的金属可以从盐溶液中置换出不太活泼的金属。
(2)金属与酸反应生成盐和氢气
①Fe+H2SO4====FeSO4+H2↑ ; 置换反应
②CuSO4+Fe====FeSO4+Cu ; 置换反应
1.活泼的金属可以置换出酸中的氢
2.活泼的金属可以从盐溶液中置换出不太活泼的金属。

练习册系列答案
相关题目