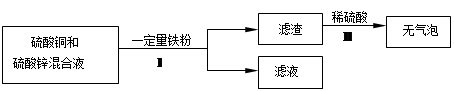题目内容
(3分)某校化学实验室废液桶中收集了含有FeSO4、CuSO4的废水,若直接排放到下水道不 仅造成重金属污染而且造成浪费。化学兴趣小组的同学们设计回收硫酸亚铁晶体和铜的实验方案如下: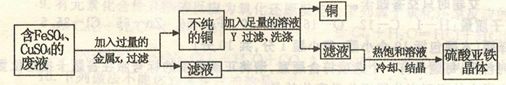
请回答下列问题:
(1)实验过程中多次采取过滤,该操作用到的玻璃仪器有烧杯、 和玻璃棒。
(2)请写出将过量金属X加入废水后反应的化学方程式。
(3)溶液Y是 。
(1)漏斗 (2)Fe+CuSO4==Cu+FeSO4 (3)稀硫酸
解析试题分析:(1)过滤操作用到的玻璃仪器有烧杯、漏斗和玻璃棒
(2)最终要得到铜和硫酸亚铁晶体,故可推知过量金属X应该是铁,所以将过量金属X加入废水后反应的化学方程式:Fe+CuSO4==Cu+FeSO4
(3)由于加入的金属X是过量,所以不纯的铜应该是铁和铜的混合物,故加入的溶液Y实际就是除去铜中过量的铁,同时生成硫酸亚铁,故溶液Y是稀硫酸
考点:过滤操作,金属的化学性质

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
(8分)小强同学分别取溶质质量分数相同的稀盐酸,大小、形状都相同的某种金属X、Al、Cu 进行实验,实验现象记录如下
| | | Al | X | Cu |
| 现象 | 开始时 | 几乎无气泡产生 | 产生气泡速度慢 | 无气泡产生 |
| 一段时间后 | 产生气泡速度快 | 产生气泡速度慢 | 无气泡产生 |
(1)实验开始时,铝表面几乎无气泡产生的原因是__________________ ___;
(2)Cu表面始终无气泡产生的原因是___________ _____;
(3)三种金属的活动性由强到弱的顺序是 ;
(4)如果金属X的活动性比铁弱,且金属X与稀盐酸反应后生成易溶于水的XCl2。向只含有XCl2、CuCl2两种溶质的溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入稀盐酸,没有气泡产生。则滤液中一定含有的金属阳离子是 (用离子符号表示)。