题目内容
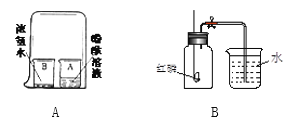
【题目】(一)小刚要模拟自来水厂的净水过程,其实验过程如下所示。请回答以下问题:

(1)A物质的名称是______(选序号填写)。 ①活性炭 ②明矾
(2)操作①的名称是______, 通过操作①可除去水样中的______(填“可溶性”或“不溶性”)杂质。在操作①中玻璃棒的作用是______,若经过操作①后,所得液体C中仍有浑浊,其原因可能是______(填序号)。
a.漏斗内的滤纸有破损 b.漏斗下端未靠在烧杯内壁 c.漏斗内液面高于滤纸的边缘
(3)操作②主要是除去一些异味和色素,应选用的物质是______,该过程主要是___(填“物理”或“化学”)变化。
(4)小刚取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是____水,日常生活中常用______方法使其软化后使用。
(5)上海世博园区内用“活性炭+超滤膜+紫外线”组合工艺获得直饮水。其中用紫外线代替氯气对水进行处理,其作用是______。
(二)水是生命之源,万物之基,是人类最宝贵的自然资源。
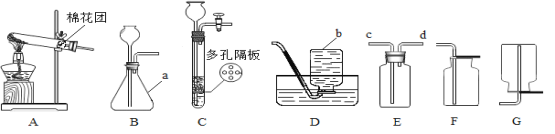
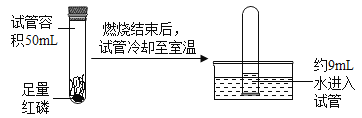
(6)电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。为了测定水的组成,兴趣小组采取甲乙两种方案进行如下探究:
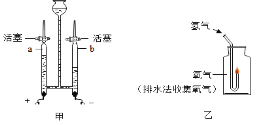
甲方案:电解水时玻璃管内的现象是________________,________________(写2点);
b管内生成的气体是___;检验a管内产生气体的方法是____________________,该实验说明水是由氢、氧元素组成的理论依据是_______________________________。
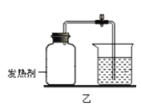
乙方案:该方案的实验目的是__________,氢气在氧气中燃烧,反应的符号表达式是
___________________________________。
现象_______________________________;该实验能否达到实验目的,并阐述理由:
__,___________________________。
(7)下图是某空间站能量转化系统局部示意图,其中水电解系统及燃料电池系统中的溶液均采用氢氧化钠溶液,下列有关说法正确的是_______。

A.该能量转化系统中的水可以循环使用
B.燃料电池系统产生的能量实际上来自于水
C.氢元素在循环过程中,没有发生化学反应
D.水电解系统中氢氧化钠溶液中的水经电解部分消耗后,氢氧化钠溶液浓度变大
【答案】②过滤,不溶性,引流 ,a c活性炭 ,物理硬水,煮沸杀菌消毒电极上产生气泡,玻璃管内液面下降,一段时间后a、b管中气体体积比为1:2(写2点即可)。氢气,将带火星的木条放在尖嘴处,木条复燃。质量守恒定律(或者化学变化前后元素的种类不变)。测定水的组成;2H2+O2![]() 2H2O;管口有淡蓝色火焰,集气瓶壁上有水雾出现;否,排水法收集的氧气中含水蒸气,影响实验的测定。AD
2H2O;管口有淡蓝色火焰,集气瓶壁上有水雾出现;否,排水法收集的氧气中含水蒸气,影响实验的测定。AD
【解析】
(1)河水的静置沉淀的过程中加入絮凝剂明矾,加速沉降,故选②。
(2)步骤1是将固体和液体分离的过程,故是过滤。过滤可以除去水中的难溶性的杂质。过滤步骤中的玻璃棒的作用是引流。过滤过程中a.漏斗内的滤纸有破损会使过滤不干净, b.漏斗下端未靠在烧杯内壁会使液体外溅,不会造成滤液不干净, c.漏斗内液面高于滤纸的边缘,滤液会沿滤纸和漏斗边缘未经过过滤直接进入滤液中,故滤液可能浑浊,故选ac。
(3)吸附过程中用到的物质是活性炭,该过程中没有新物质的生成,故是物理变化。
(4)检验软硬水的方法是向水中加入肥皂水,如泡沫多浮渣少的水是硬水。煮沸可以使水中的可溶性的钙镁化合物转化为难溶性的钙镁化合物沉淀出来,故可以降低水的硬度。
(5)用紫外线代替氯气对水进行处理,其作用是杀菌消毒。
(6)电解水实验中可以观察到的现象是电极上产生气泡;玻璃管内液面下降,一段时间后a、b管中气体体积比为1:2。该实验中与负极相连的电极产生的气体是氢气。a管内产生的气体是氧气,检验氧气的方法是用带火星的木条放在尖嘴处,木条复燃,说明是氧气。电解水实验生成氢气和氧气,根据质量守恒定律,说明水是由氢元素和氧元素组成的。
(7)该实验是将氢气在氧气中燃烧,燃烧后生成水,故该实验的目的是测定水的组成。氢气在氧气中点燃生成水,反应的符合表达式为:2H2+O2![]() 2H2O。氢气在氧气中燃烧的现象是管口有淡蓝色火焰,集气瓶壁上有水雾出现。该实验不能测定水的组成,因为用排水法收集的氧气中混有水蒸气,影响实验结果,故不能确定。
2H2O。氢气在氧气中燃烧的现象是管口有淡蓝色火焰,集气瓶壁上有水雾出现。该实验不能测定水的组成,因为用排水法收集的氧气中混有水蒸气,影响实验结果,故不能确定。
(8)A、由图可知,该过程中水电解生成了氢气和氧气,氢气和氧气点燃反应生成了水,故可以循环使用的是水;B、燃料电池系统产生的能量来源于太阳能,则说法错误。C、该反应的过程中,氢元素参与了反应,故错误;D、水电解系统中氢氧化钠溶液中的水经电解部分消耗后,水的质量减小,氢氧化钠溶液浓度变大,故正确。故选AD。

 名校课堂系列答案
名校课堂系列答案