题目内容
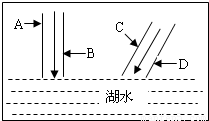
(2009?白下区二模)如图所示,两条河的河水流入湖中.某校环保小组到河边四家工厂调查,这四家工厂A、B、C、D依次分别排出的废水中含有H2SO4、K2CO3、Ca(OH)2、FeCl3.(1)请书写A、B废水汇合处的化学方程式:
______.
(2)请书写C、D废水汇合处的化学方程式:
______.
(3)河边工厂排出的废水有的呈酸性,有的呈碱性.若要检测最终湖水的酸碱性和酸碱度,应如何操作?(请简述操作步骤)
酸碱性:______;酸碱度:______.
【答案】分析:书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据质量守恒定律的两个原则.
解答:解:(1)A处的废水中的硫酸与B处的废水中的碳酸钾反应生成硫酸钾、水和二氧化碳.
该反应的化学方程式为:K2CO3+H2SO4═K2SO4+H2O+CO2↑.
(2)C处的废水中的氢氧化钙与D处的废水中的氯化铁反应生成氢氧化铁沉淀和氯化钙.
该反应的化学方程式为:2FeCl3+3Ca(OH)2═2Fe(OH)3↓+3CaCl2.
(3)溶液的酸碱性可以用紫色石蕊试液来检验,酸性溶液能使紫色石蕊试液变红色.因此可以通过如下的操作来检验溶液的酸碱性:取少量湖水水样于试管中,滴加1~2滴紫色石蕊试液,观察溶液的颜色.
溶液的酸碱度可以用pH试纸来检验,具体的操作是:用玻璃棒蘸取湖水水样滴到pH试纸上,与标准比色卡对比,读出pH值.
故答案为:
(1)K2CO3+H2SO4═K2SO4+H2O+CO2↑;
(2)2FeCl3+3Ca(OH)2═2Fe(OH)3↓+3CaCl2;
(3)取少量湖水水样于试管中,滴加1~2滴紫色石蕊试液,观察溶液的颜色;
用玻璃棒蘸取湖水水样滴到pH试纸上,与标准比色卡对比,读出pH值.
点评:本题主要考查化学方程式的书写、酸碱性和酸碱度的检验,难度较小.
解答:解:(1)A处的废水中的硫酸与B处的废水中的碳酸钾反应生成硫酸钾、水和二氧化碳.
该反应的化学方程式为:K2CO3+H2SO4═K2SO4+H2O+CO2↑.
(2)C处的废水中的氢氧化钙与D处的废水中的氯化铁反应生成氢氧化铁沉淀和氯化钙.
该反应的化学方程式为:2FeCl3+3Ca(OH)2═2Fe(OH)3↓+3CaCl2.
(3)溶液的酸碱性可以用紫色石蕊试液来检验,酸性溶液能使紫色石蕊试液变红色.因此可以通过如下的操作来检验溶液的酸碱性:取少量湖水水样于试管中,滴加1~2滴紫色石蕊试液,观察溶液的颜色.
溶液的酸碱度可以用pH试纸来检验,具体的操作是:用玻璃棒蘸取湖水水样滴到pH试纸上,与标准比色卡对比,读出pH值.
故答案为:
(1)K2CO3+H2SO4═K2SO4+H2O+CO2↑;
(2)2FeCl3+3Ca(OH)2═2Fe(OH)3↓+3CaCl2;
(3)取少量湖水水样于试管中,滴加1~2滴紫色石蕊试液,观察溶液的颜色;
用玻璃棒蘸取湖水水样滴到pH试纸上,与标准比色卡对比,读出pH值.
点评:本题主要考查化学方程式的书写、酸碱性和酸碱度的检验,难度较小.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
(2009?白下区二模)某研究性小组做了如下的实验:取50g石灰石样品(杂质不溶于水,不发生化学反应,也不含钙元素)放入锥形瓶中,并加入足量稀盐酸.实验装置如下图所示,已知锥形瓶连同瓶中石灰石样品和稀盐酸以及瓶口棉花起始时的总质量为300.0g.实验数据记录如下表:
(1)表中M=______g.
(2)依据实验数据记录作出生成CO2的质量与时间关系的图象:

(3)请计算该石灰石样品中碳酸钙的质量分数.(请写出计算过程)
(4)取该石灰石样品100g,高温灼烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,计算所得氧化钙的质量.(请写出计算过程)

| 时间/min | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| 电子天平示数/g | 294.5 | 290.0 | 286.0 | 284.0 | 283.0 | 282.4 | M | 282.4 |
(2)依据实验数据记录作出生成CO2的质量与时间关系的图象:

(3)请计算该石灰石样品中碳酸钙的质量分数.(请写出计算过程)
(4)取该石灰石样品100g,高温灼烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,计算所得氧化钙的质量.(请写出计算过程)



