题目内容
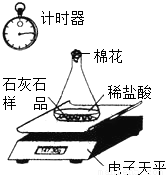
(2009?白下区二模)某研究性小组做了如下的实验:取50g石灰石样品(杂质不溶于水,不发生化学反应,也不含钙元素)放入锥形瓶中,并加入足量稀盐酸.实验装置如下图所示,已知锥形瓶连同瓶中石灰石样品和稀盐酸以及瓶口棉花起始时的总质量为300.0g.实验数据记录如下表:| 时间/min | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| 电子天平示数/g | 294.5 | 290.0 | 286.0 | 284.0 | 283.0 | 282.4 | M | 282.4 |
(2)依据实验数据记录作出生成CO2的质量与时间关系的图象:

(3)请计算该石灰石样品中碳酸钙的质量分数.(请写出计算过程)
(4)取该石灰石样品100g,高温灼烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,计算所得氧化钙的质量.(请写出计算过程)
【答案】分析:(1)12min和16min时的数据相同,说明12min时反应已完成,那么14 min时的数据应该和12min、16min时的一样.
(2)电子天平示数应该是参与反应的物质总量减去反应过程中生成的CO2的质量,因此CO2的质量即总量减去电子天平示数.
(3)根据化学方程式,可以求出各物质之间的质量比,进而求出碳酸钙的质量,再根据质量分数公式,可求出石灰石样品中碳酸钙的质量分数.
(4)根据化学方程式,求出各物质之间的质量比,再求出所需数据,进行计算.
解答:答:(1)12min和16min时的数据相同,说明12min时反应已完成,那么14 min时的数据应该和12min、16min时的一样,故表中M的值应该是282.4.
(2)如图;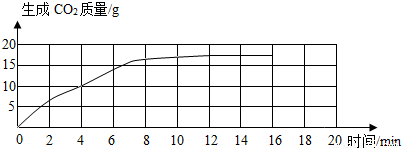
(3)解:反应生成二氧化碳的质量为:300.0g-282.4=17.6g
设石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 4
x 17.6g
∴100:44=x:17.6g
解之得:x=40g
∴石灰石样品中碳酸钙的质量分数为: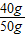 ×100%=80%
×100%=80%
答:石灰石样品中碳酸钙的质量分数为80%.
(4)解:该石灰石样品中钙元素的质量为:100g×80%× =32g
=32g
高温灼烧后剩余固体的质量为: =78g
=78g
反应生成二氧化碳的质量为:100g-78g=22g
设生成氧化钙的质量为y.
CaCO3═CaO+CO2↑
56 44
y 22g
∴56:44=y:22g
解之得y=28g
答:所得氧化钙的质量为28g.
点评:本题要求学生熟悉完全反应的概念,并能据此答题,能熟练运用溶质质量分数公式进行计算,才能举一反三,触类旁通.
(2)电子天平示数应该是参与反应的物质总量减去反应过程中生成的CO2的质量,因此CO2的质量即总量减去电子天平示数.
(3)根据化学方程式,可以求出各物质之间的质量比,进而求出碳酸钙的质量,再根据质量分数公式,可求出石灰石样品中碳酸钙的质量分数.
(4)根据化学方程式,求出各物质之间的质量比,再求出所需数据,进行计算.
解答:答:(1)12min和16min时的数据相同,说明12min时反应已完成,那么14 min时的数据应该和12min、16min时的一样,故表中M的值应该是282.4.
(2)如图;

(3)解:反应生成二氧化碳的质量为:300.0g-282.4=17.6g
设石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 4
x 17.6g
∴100:44=x:17.6g
解之得:x=40g
∴石灰石样品中碳酸钙的质量分数为:
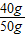 ×100%=80%
×100%=80%答:石灰石样品中碳酸钙的质量分数为80%.
(4)解:该石灰石样品中钙元素的质量为:100g×80%×
 =32g
=32g高温灼烧后剩余固体的质量为:
 =78g
=78g反应生成二氧化碳的质量为:100g-78g=22g
设生成氧化钙的质量为y.
CaCO3═CaO+CO2↑
56 44
y 22g
∴56:44=y:22g
解之得y=28g
答:所得氧化钙的质量为28g.
点评:本题要求学生熟悉完全反应的概念,并能据此答题,能熟练运用溶质质量分数公式进行计算,才能举一反三,触类旁通.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


