题目内容
(6分)金属在生产生活中应用广泛.
(1)下列厨房用品所使用的主要材料,利用金属导热性的是 (填字母序号).
(2)汽车表面喷漆,可以延缓钢铁的锈蚀,其防锈原理是隔绝 .
(3)根据图示中的变化,下列结论正确的是 (填字母序号).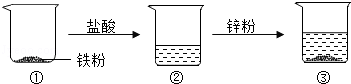
| A.烧杯②中溶液含有盐酸 | B.烧杯③中一定没有盐酸 |
| C.烧杯③中溶液为氯化锌溶液 | D.烧杯③中的固体可能是铁. |
(1) BC (2) 氧气和水蒸气 (3) BD
解析试题分析:(1)制作菜刀是利用铁的硬度大;铜做锅是利用铜的导热性好;不锈钢做炒菜锅是利用不锈钢的导热性好;
(2)铁生锈的条件是与氧气、水同时接触,汽车表面喷漆,可以延缓钢铁的锈蚀,其防锈原理是隔绝氧气和水蒸气;
(3)烧杯②中没有铁粉剩余,说明铁与盐酸恰好完全反应或盐酸过滤;烧杯③中有固体剩余,说明锌过量,盐酸完全反应或锌与氯化亚铁反应生成的铁。
考点:金属及其性质

练习册系列答案
相关题目
世界每年因腐蚀而报废的金属设备和材料相当于年产量的20% ~ 40% ,为探究铁锈蚀条件,某同学设计的实验如图所示,一周后观察到_______(填序号)试管内的铁钉生锈。请分析铁生锈的条件及防锈措施。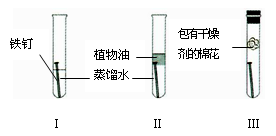
(7分)使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放。
|
(3)制镁的原料MgO可从海水中获得。小华利用镁与盐酸反应后的废液,模拟从海水中获取MgO的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入CaO,至MgCl2完全沉淀为止,过滤得Mg(OH)2固体。共消耗8.4g CaO。
步骤2:将Mg(OH)2固体加热分解为MgO和水,所得MgO的质量为4.0g 。
①步骤2中Mg(OH)2分解的化学方程式为 。
②通过所得MgO的质量计算上述废液中含MgCl2的质量m= g。
③分析实验数据,可知步骤Ⅰ中反生的化学反应有:
CaO+H2O==Ca(OH)2;Ca(OH)2+MgCl2==CaCl2+Mg(OH)2↓; 。