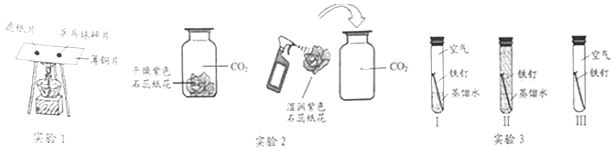
题目内容
【题目】取Cu-Mg合金30g放入烧杯,将100g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下,请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 25 | 25 | 25 | 25 |
剩余固体质量/g | 28.8 | 27.6 | 26.4 | 25.4 |
(1)合金中Cu的质量是_______________________.
(2)请用实验第1次的数据,计算所加稀硫酸的溶质的质量分数。(写出计算过程,计算结果精确到0.1%)____________。
【答案】 25.4g 19.6%
【解析】(1)Mg和稀硫酸反应生成硫酸锌和氢气,铜不能和稀硫酸反应,由表中数据分析可以知道,每25g稀硫酸消耗Mg的质量为1.2g,而第四次只消耗了16.4g25.4g=1g,由此可以判断剩余的25.4g固体为铜;(2)设25g稀硫酸中硫酸的质量为x
Mg+H2SO4═MgSO4+H2↑
24 98
1.2g x
![]() ,解得:
,解得: ![]() =4.9g
=4.9g
所加稀H2SO4的溶质的质量分数为: ![]() 。
。
答:(1)合金中Cu的质量是25.4g,(2)所加稀H2SO4的溶质的质量分数为19.6%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】用如下图所示装置,在常温下,进行研究空气中氧气含量的实验。
内容 | 【实验】测定空气中氧气含量 |
实验 步骤 | 燃烧匙中放足量白磷,烧杯中盛放足量水,用激光手电照射白磷,白磷燃烧起来。待白磷熄灭,冷却至室温后,打开弹簧夹,观察到______。 |
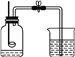
(1)实验前检查装置气密性:打开弹簧夹,向烧杯中加水至液面浸没下端导管口,用手捂住广口瓶外壁,说明装置的气密性良好的现象是______________。
(2)补全实验中的实验现象。