题目内容
【题目】探究酸、碱和盐的性质及应用。
(1)NaOH溶液和稀硫酸反应,向滴有酚酞的NaOH溶液中加入稀硫酸,现象为 ,反应的化学方程式为 。
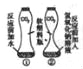
(2)为除去NaCl中混有的少量Na2SO4,某探究不组设计了如图所示方案进行实验:
![]()
①Ⅰ、Ⅱ两步都有过滤操作,过滤中要用到的玻璃仪器有 。
②甲、乙同学选用的X分别为BaCl2溶液、Ba(OH)2溶液,写出Ⅰ、Ⅱ两步中发生的任意一个反应的化学方程式 ,甲、乙同学的实验中,可能发生的相同反应的化学方程式为 ,乙的实验中,步骤Ⅲ涉及的操作和现象是 。
③丙同学认为甲的实验比乙的实验更合理,理由是 。
【答案】
(1)溶液由红色变为无色 H2SO4+2NaOH═Na2SO4+2H2O
(2)①漏斗、烧杯和玻璃棒
②Ba(OH)2+Na2SO4═BaSO4↓+2NaOH Na2CO3+2HCl═2NaCl+H2O+CO2↑
加入过量盐酸,有气泡产生
③甲实验直接生成氯化钠,不会造成药品的浪费
【解析】
试题分析:
(1)氢氧化钠溶液呈碱性,能使酚酞试液变红,加入稀硫酸,稀硫酸能与氢氧化钠反应生成硫酸钠和水,碱性消失,溶液由红色变为无色,故填:溶液由红色变为无色,H2SO4+2NaOH═Na2SO4+2H2O;
(2)①过滤操作用到的玻璃仪器有漏斗、烧杯和玻璃棒,故填:漏斗、烧杯和玻璃棒;
②氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,硫酸钠能与氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,可能相同的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,步骤Ⅲ是除去碳酸钠得到氯化钠,故加入盐酸,观察到有气泡产生,故填:Ba(OH)2 + Na2SO4 ═ BaSO4↓ + 2NaOH ;Na2CO3 + 2HCl ═ 2NaCl + H2O + CO2↑;加入过量盐酸,有气泡产生;
③乙加入的试剂是氢氧化钡,与硫酸钠反应会产生氢氧化钠,除去氢氧化钠需要加入盐酸,造成药品的浪费,故填:甲实验直接生成氯化钠,不会造成药品的浪费。