题目内容
【题目】(每空2分,共8分)
材料一:2014年5月27日,中国中航工业航材院相关人士向《环球时报》透露,他们成功利用石墨烯与铝合金在全球率先研制出“烯合金”,宣布具有特殊性能的系列材料问世。这一成果,或许将对航空航天器带来革命性变革。
材料二:石墨烯是从石墨中分离出来的单层石墨片,在室温下可以单独稳定存在,具有优异的导电、导热性能。
(1)石墨烯属于_________(填“单质”或“化合物”),写出石墨烯在空气中完全燃烧的化学反应方程式__________________。
(2)从上述材料中总结出烯合金可能具有的性质为______________(选填序号)
A.密度较小 B.硬度比铝大 C.可溶于水 D.能导电
(3)将适量的烯合金放入足量稀硫酸中,在烯合金的表面可能会产生大量气泡,请写出这种气体的化学式___________。
【答案】(1)单质 C+O2![]() CO2(未写条件扣1分)
CO2(未写条件扣1分)
(2)A、B、D(选2个且全正确给1分,但只要选了C就不给分)
(3)H2
【解析】
试题分析:(1)石墨烯是从石墨中分离出来的单层石墨片,石墨是碳元素组成的单质。所以石墨烯属于单质。它燃烧会生成二氧化碳,化学方程式为:C+O2点燃CO2。
(2)根据题意可知,烯合金是石墨烯与铝合金形成的新型复全材料。根据合金的特点可推测:其密度要小于铝合金,硬度要大于铝合金。所以AB项正确。C石墨烯与铝合金均不溶解于水,所以烯合金不溶解于水; D铝有优良的导电性,所以烯合金能导电。所以应选ABD项。
(3)烯合金中的铝可以和硫酸反应生成氢气,所以气体的化学式为: H2。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】某实验小组对实验室制取氢气的反应原理进行探究。
【知识回顾】能产生氢气的化学反应有: ①水电解 ②活泼金属与酸反应
【讨论交流】反应①的化学方程式 ;同学们讨论后认为该反应不适用于实验室制取氢气。
【实验探究】为了探究哪种物质更适合用于实验室制取氢气,大家设计了如下实验:
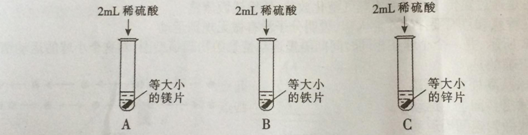
【分析与结论】填写实验报告。
实验 | 实验现象 | 实验结论 |
A | 剧烈反应,迅速产生大量气泡,试管外壁 | 反应速率过快,气体不便收集,不能用于实验室制取氢气 |
B | 缓慢产生少量气泡 | 反应速率过慢,不能用于实验室制取氢气 |
C | 较快产生大量气泡,试管外壁发热 |
通过实验得出,适合实验室制取氢气的化学反应方程式为 ;
【知识拓展】(1)确定实验室制取气体的反应原理时,要考虑诸多因素,如反应的快慢、收集的难易、 等。
(2)用稀盐酸制取氢气时,制得的气体中可能会增加的杂质为 。