题目内容
【题目】实验探究题
【实验回顾】18世纪末,英国科学家普利斯特里和卡文迪许把“易燃空气”与空气或氧气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,发出震耳的爆鸣声,且玻璃瓶内璧上出现了液滴。一年之后,拉瓦锡重复了他们的实验,并做了一个相反的实验:让水蒸气通过一根烧红的枪管,得到了“易燃空气”。这里的“易燃空气”是指________(填化学式),通过上述实验得到的结论是____________________。
【实验重现】某化学兴趣小组的同学在创新的基础上,在实验室中重做上述两个实验,做法如下:
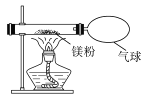
实验1:水的通电分解实验
如右图所示,打开活塞b,用燃着的木条在玻璃管尖嘴口检验反应产生的气体,看到的现象是________,证明该气体为_______。
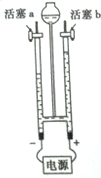
实验2: “易燃空气”与氧气混合后的点燃实验
实验室现有过氧化氢溶液、氯酸钾、二氧化锰、稀硫酸、锌粒,以下是实验室常用部分仪器:
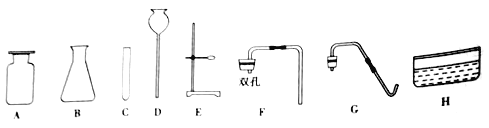
(l)指出图中仪器的名称:D______。
(2)利用上述仪器和药品制取少量氧气,其简易发生装置应选择的仪器有_____(填序号),反应的化学方程式为______________。
(3)利用上述仪移和药品制取较多量的“易燃空气”,且可以随时补充液体,你选择的仪器有_____(填序号),药品是_____。该兴趣小组的同学把“易燃空气”与氧气按一定比例混合后盛在干澡、洁净的玻璃瓶中,用电火花点火,顺利完成上述实验。
(4)该兴趣小组的同学决定利用制得的“易燃空气”和空气继续进行探究,他们取7支试管,依次盛水90%(体积分数)、80%……再用排水集气法收集“易燃空气”,而后分别把试管口移近酒精灯的火焰,实验结果如下表所示:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
“易燃空气”体积分数(%) | 90 | 80 | 70 | 50 | 20 | 10 | 5 |
空气体积分数(%) | 10 | 20 | 30 | 50 | 80 | 90 | 95 |
点燃现象 | 安静 燃烧 | 安静 燃烧 | 弱的 爆鸣声 | 强的 爆鸣声 | 强的 爆鸣声 | 弱的 爆鸣声 | 不燃烧 不爆鸣 |
分析表中信息,完成下列问题:
① 在混合气体爆炸范围内,“易燃空气” 的体积分数约为________;
②你对燃烧或燃烧条件的新认识是___________________。
【答案】【实验回顾】H2(1分)水是由氢、氧两种元素组成(1分)
【实验重现】实验1:木条燃烧更剧烈(1分)氧气(1分)
实验2:(1)长颈漏斗(1分)(2)CEG(1分,与顺序无关)2H2O2![]() 2H2O+O2↑(2分)
2H2O+O2↑(2分)
(3)BDFA(1分,与顺序无关)锌和稀硫酸(1分,也可以写化学式)
(4)①10%~70%(2分)②可燃物虽愚氧气接触,且达到着火点,燃烧也可能不发生。(2分,是否燃烧也与氧气的浓度或可燃物的浓度有关等其它答案均可)
【解析】【实验回顾】铁和水在高温下反应生成氢气,H2;据质量守恒定律可知反应前后元素种类不变,所以由实验课证明水是由氢、氧两种元素组成;【实验重现】实验1:木条燃烧更剧烈说明生成的气体是由助燃性的氧气。实验2:(1)长颈漏斗;(2)品制取少量氧气反应容器应选择试管,然后用铁架台固定,其简易发生装置应选择的仪器有CEG;过氧化氢在二氧化锰的作用下分解生成氧气和水,反应方程式为2H2O2 MnO2 2H2O+O2↑;(3)制取氢气,可以随时补充液体,选择的仪器有长颈漏斗,双孔塞、锥形瓶,和收集气体的集气瓶。实验室制取氢气锌和稀硫酸,反应速率适中,制取的气体比较纯净。(4)①由题中表格中的数据可知,氢气的爆炸极限是10%~70%;②对燃烧或燃烧条件的新认识是可燃物虽与氧气接触,且达到着火点,但是可燃物的含量不在爆炸极限范围内时,燃烧也可能不发生。

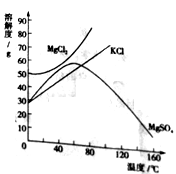
【题目】根据表中信息,请回答下列问题:
部分碱、酸、盐的溶解性表(20℃)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- | PO43- |
H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | 溶 | |
K+ | 溶 | 溶 | 溶 | 溶 | 溶 | 溶 |
Na+ | 溶 | 溶 | 溶 | 溶 | 溶 | 溶溶 |
Ba2+ | 溶 | 溶 | 溶 | 不 | 不 | 不 |
Ca2+ | 微 | 溶 | 溶 | 微 | 不 | 不 |
Cu2+ | 不 | 溶 | 溶 | 溶 | — | 不 |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“徽”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
(1)CaCO3属于______(填“可溶物”、”徽溶物”或“不溶物”)。
(2)表中可溶于水的硫酸盐有__种。
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应。若能,写出化学方程式;若不能,说明理由。______
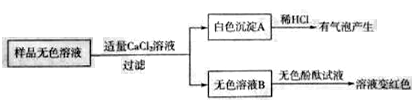
(4)某同学将盐酸倒入Ba(OH)2溶液中,得到溶液甲。
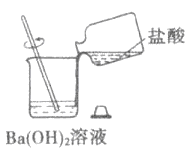
① 溶液甲中溶质的组成情况可能有______种。
② 实验设计:探究溶液甲中可能含有的溶质
a.探究溶液甲中是否含盐酸
方案编号 | 实验操作 | 实验现象 |
1 | 取少量溶液甲于试管中,加入铁粉 | 是否_________ |
b.探究溶液甲中是否含Ba(OH)2
方案编号 | 实验操作 | 实验现象 |
2 | 取少量溶液甲于试管中,加入_______溶液 | 是否产生蓝色沉淀 |
3 | 取少量溶液甲于试管中,加入Na2SO4溶液 | 是否产生白色沉淀 |
上述三个方案中有一个不合理,请指出不合理的方案编号并说明理由:__________。
③ 欲从溶液甲中获得纯净的日BaCl2固体,应采取的简单操作是_________。