题目内容
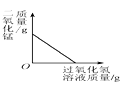
【题目】如下图中的A~I是初中化学中常见的九种物质,是由C、H、O、Fe、Cu五种元素组成的单质或氧化物,其中C、F、H、I为氧化物,且C中氧元素的质量分数为20%;B、H为红色固体;通常D→B是在溶液中发生的反应。图中“—”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系;部分反应物或生成物已略去。

(1)H的化学式为__________。
(2)F—H反应的化学方程式为:___________,该反应的用途是___________。
(3)写出D→B的化学方程式_____________,该基本反应类型是____________。
【答案】 Fe2O3 3CO+Fe2O3![]() 2Fe+3CO2 (高炉)炼铁 Fe+CuSO4===Cu+FeSO4 置换反应(必须有反应二字)
2Fe+3CO2 (高炉)炼铁 Fe+CuSO4===Cu+FeSO4 置换反应(必须有反应二字)
【解析】A~I是初中化学常见的物质,是由C、H、O、Fe、Cu五种元素组成的单质或氧化物,其中C、F、H、I为氧化物,且C中氧元素的质量分数为20%;B、H为红色固体;通常D→B是在溶液中发生的反应,所以H是氧化铁,C是氧化铜,B是铜,所以D是铁,氧化铜会与F反应,F会转化成B,所以F是一氧化碳, A、G是碳或氢气,E是氧气,I是二氧化碳,经过验证,推导正确;(1) H是氧化铁,化学式为Fe2O3;(2)一氧化碳和氧化铁反应化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;此原理应用于炼铁;(3)铁在溶液中生成铜的化学方程式为:Fe+CuSO4=Cu+FeSO4;此反应属于置换反应。
2Fe+3CO2;此原理应用于炼铁;(3)铁在溶液中生成铜的化学方程式为:Fe+CuSO4=Cu+FeSO4;此反应属于置换反应。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】钙是维持人体正常功能所必需的元素。
如图所示为某种补钙剂“钙尔奇”说明书的一部分。取1片钙尔奇,放入盛有10 g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其他成分与盐酸不反应)。烧杯内物质质量变为11.34 g。试计算:
钙尔奇 caltrate |
(1)每片钙尔奇中含碳酸钙的质量。
(2)服用这种补钙剂,每人每天摄入钙元素的质量。
(3)所用稀盐酸中溶质的质量分数。
【题目】空气中氧气含量测定的再认识。
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。
(1)该实验中选择使用汞的优点有。
A.实验过程中没有污染
B.在汞槽中起到液封的作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
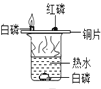
(2)【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的化学方程式 , 其反应类型为。
兴趣小组用该方法测出的氧气含量常常远低于21%。
(3)【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】①;② , 装置内氧气有剩余;……
(4)【实验与交流】在老师的指导下,小明分别用过量的红磷(着火点240℃)和白磷(着火点40℃)进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%。请从燃烧条件的角度回答产生上述结果的主要原因。。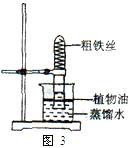
(5)【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量。于是进行了实验(装置如图3)。通过7天测得的数据计算出空气中氧气的含量为19.13%。
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点。(填字母)。
A.装置内残留的氧气更少
B.反应更彻底,实验结果更准确
C.铁丝生锈比红磷燃烧反应更快
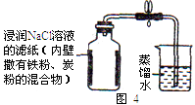
(6)【实验探究2】为了加快反应速率,小明通过查闻资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4)。8分钟后测得的数据如下表:
实验前的体积 |
| |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131 mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量(计算结果保留一位小数)。
(7)【结论与反思】通过上述实验探究,选择(填字母)进行实验,可较为快速地完成实验并减小实验误差。
A.红磷
B.白磷
C.铁粉、炭粉、氯化钠、蒸馏水
(8)【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿主要成分为Cu2(OH)2CO3]。若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由。、理由(填字母)。
A.空气中CO2含量只有约0.03%,铜不能将装置内的氧气几乎耗尽
b.铜丝反应比铁丝快
c.反应更彻底
【题目】根据下列实验方案进行实验,能达到相应实验目的的是
编号 | A | B | C | D |
实验 装置 |
|
|
|
|
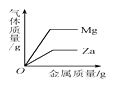
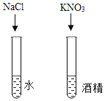
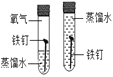
实验 目的 | 探究燃烧条件之一需要可燃物 | 探究影响物质溶解性的因素 | 探究铁钉生锈时O2是否参与反应 | 比较Zn和Fe的 金属活动性强弱 |
A. A B. B C. C D. D