题目内容
配制溶质质量分数一定的氯化钠溶液常按以下操作顺序进行.请回答下列问题:
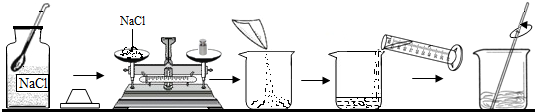
(1)计算配制100g溶质质量分数为5%的氯化钠溶液所需:氯化钠
(2)用托盘天平衡量所需的氯化钠时,发现托盘天平的指针偏向左盘,应
A.增加适量氯化钠固体B.减少适量氯化钠固体C.调节平衡螺母;
(3)用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是

(1)计算配制100g溶质质量分数为5%的氯化钠溶液所需:氯化钠
5
5
g,水95
95
g.(2)用托盘天平衡量所需的氯化钠时,发现托盘天平的指针偏向左盘,应
B
B
.A.增加适量氯化钠固体B.减少适量氯化钠固体C.调节平衡螺母;
(3)用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是
100mL
100mL
(从下列中选用:10mL、25mL、50mL、100mL);若仰视量取水,则所配制的溶液的质量分数会偏小
偏小
(填“偏大”、“偏小”或“无影响”)(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是
搅拌加速氯化钠溶解
搅拌加速氯化钠溶解
.分析:(1)溶质质量=溶液质量×溶质质量分数;水=溶液质量-溶质质量;(2)指针偏向左盘说明氯化钠称多了再进行分析;(3)根据量筒的选取方法和仰视读数量取水的多少考虑;(4)根据玻璃棒搅拌的目的考虑.
解答:解:(1)氯化钠:100g×5%=5g,水:100g-5g=95g;
(2)因为在称量药品时左物右码,托盘天平的指针偏向左盘说明氯化钠称多了,所以要减少药品;
(3)量筒选取:选取比所量取的液体体积小,且最接近的,所以用100mL量筒;仰视量取水看到的读数小,但量取到的实际液体偏多,即量取的水多了,所以溶质质量分数偏小;
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌是为了加速氯化钠的溶解速度,使氯化钠溶解的快一点.
故答案为:(1)5;95;(2)B;(3)100mL;偏小;(4)搅拌加速氯化钠溶解.
(2)因为在称量药品时左物右码,托盘天平的指针偏向左盘说明氯化钠称多了,所以要减少药品;
(3)量筒选取:选取比所量取的液体体积小,且最接近的,所以用100mL量筒;仰视量取水看到的读数小,但量取到的实际液体偏多,即量取的水多了,所以溶质质量分数偏小;
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌是为了加速氯化钠的溶解速度,使氯化钠溶解的快一点.
故答案为:(1)5;95;(2)B;(3)100mL;偏小;(4)搅拌加速氯化钠溶解.
点评:解答本题关键是要知道溶质、溶剂的计算方法,知道天平称量药品时的注意事项,量筒选取原则,溶质质量分数偏大还是偏小要从两个方面考虑:溶质多了,溶剂少了溶质质量分数就会增大;如果溶质少了,溶剂多了,溶质质量分数就会减少.

练习册系列答案
相关题目

