题目内容
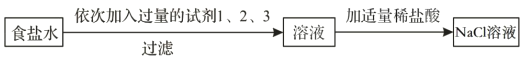
【题目】某工厂欲测定铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:

(1)写出发生反应的化学方程式__________。
(2)根据已知条件列出第一次消耗稀盐酸的溶质质量为(x)的比例式__________。
(3)铝土矿中氧化铝的含量为__________。
(4)为了得到 26.7%的氯化铝溶液,通过计算,你需要将滤液蒸发__________水。
(5)用浓盐酸配置上述稀盐酸,需要的仪器有:烧杯、玻璃棒、胶头滴管和__________。
【答案】Al2O3+6HCl=2AlCl3+3H2O 102:219=10.2g:x 60% 20.4g 量筒
【解析】
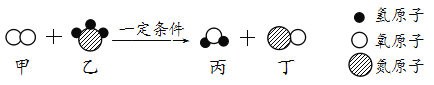
(1)由图可知,反应是氧化铝与稀盐酸反应生成氯化铝和水,故反应的化学方程式写为:Al2O3+6HCl=2AlCl3+3H2O。
(2)由图可知,参加反应的氧化铝的质量=210.2g200g=10.2g,由(1)化学方程式可知,参加反应的氧化铝与参加反应的盐酸中的溶质的质量比=102:219,设第一次消耗稀盐酸的溶质质量为x,则根据已知条件列出第一次消耗稀盐酸的溶质质量为(x)的比例式为:102:219=10.2g:x,故填102:219=10.2g:x。
(3)解:第一次则参加反应的氧化铝的质量=210.2g200g=10.2g,铝土矿中氧化铝的含量=![]() ×100%=60%,故填60%。
×100%=60%,故填60%。
(4)解:参加反应的氧化铝的质量=10.2g+20g9.8g=20.4g
设反应后生成氯化铝的质量为x
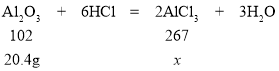
102:267=20.4g:x
x=53.4g
设蒸发掉水的质量为y
![]() ×100%=26.7%
×100%=26.7%
y=20.4g
答:需要蒸发掉水的质量为20.4g。
(5)稀释浓盐酸时,用到的仪器有烧杯、玻璃棒、胶头滴管和量筒,故填量筒。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案