题目内容
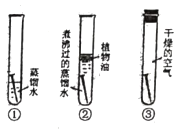
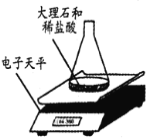
【题目】某同学对“影响稀盐酸和大理石反应快慢的因素”进行探究。选取的药品:成分相同的粉末状大理石、块状大理石两种样品;浓度为16%、9%的稀盐酸。采用控制变量法设计实验方案,以5分钟内收集到CO2的质量作为判断依据。已知稀盐酸足量且样品中杂质不与稀盐酸反应,实验装置如图。读取电子天平的示数,据此计算生成的CO2的质量,记录的数据如下表
实验序号 | 大理石 (各6g) | 稀盐酸的浓度 | 反应开始到5分钟产生CO2的质量 | 反应结束产生的CO2的质量 |
① | 块状 | 16% | 2.16 g | 2.2 g |
② | 块状 | 9% | 1.42 g | 2.2 g |
③ | 粉末 | 16% | 2.33 g | 2.2 g |
④ | 粉末 | 9% | 1.93 g | m 2g |
(1)稀盐酸的浓度对该反应快慢的影响: __________。
(2)实验过程中,通过观察如图装置中的哪一现象可判断反应结束__________。
(3)结合表格分析,实验④反应结束后m2的值________。
(4)探究大理石的颗粒大小对该反应快慢的影响,其实验序号分别是__________。
【答案】浓度越大反应速率越快 没有气泡产生或质量不再减少 2.2 ①③或②④
【解析】
(1)由①与②或③与④对比可知,同种形状的大理石与盐酸反应时,盐酸的浓度越大,在5分钟内生成的二氧化碳越多,即反应速率越快;
(2)当碳酸钙与稀盐酸反应结束后就不再有二氧化碳生成,所以没有气泡产生或质量不再减少时,反应即结束;
(3)等质量的大理石与足量的稀盐酸反应后生成的二氧化碳的质量相同,均为2.2g;
(4)要探究大理石的颗粒大小对该反应快慢的影响,应该选择稀盐酸的浓度相同的,但是大理石的颗粒大小不同的两组进行对比,如①③或②④。

【题目】如图所示,超市的洗涤用品区域有一种叫做“污渍爆炸盐”的新型洗涤剂,能清除衣服上难以清洗的黄斑、血渍、奶渍等。某化学兴趣小组的同学对“污渍爆炸盐”与水作用后的产物进行了探究。

(1)查阅资料:“污渍爆炸盐”的主要成分是过碳酸钠(Na2CO4),它是白色结晶颗粒,与水作用会产生碳酸盐和其他化合物。
(2)小明猜想其他化合物为:Ⅰ.NaOH;Ⅱ.H2O2;Ⅲ.NaOH和H2O2,小明作出以上猜想的理论依据是_____。
(3)实验设计:探究“污渍爆炸盐”水溶液的成分完成下列表格。
实验步骤 | 实验现象 | 实验结论 |
步骤1:取少量“污渍爆炸盐”于烧杯中,加入足 量蒸馏水,充分搅拌。 | 固体完全溶解,形成无色溶液 | / |
步骤2:取少量步骤1形成的溶液于试管中,再加入足量氯化钙溶液。 | _____ | 含有Na2CO3 |
步骤3:取少量步骤2试管中的上层清液于另一支 试管中,再滴加少量MgCl2溶液,振荡。 | 无明显现象 | _____ |
步骤4:另取一支试管,加入少量步骤1形成的溶 液,再加入少量二氧化锰,将带火星木条伸入试管中。 | 带火星的木条复燃 | 含有H2O2 |
(4)实验结论:猜想Ⅱ正确。
写出过碳酸钠与水反应的化学方程式_____。