题目内容
【题目】(5分)某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4 g钢样品和30.0 g稀盐酸(足量)放入质量为130.0 g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量,记录如下表:
反应时间 | T0 | T1 | T2 | T3 |
烧杯和药品质量/ g | 171.4 | 171.3 | 171.0 | 171.0 |
(1)计算这种钢样品中铁的质量分数。(最后结果精确到0.1%)
(2)某钢厂欲冶炼1120 t这种钢材,需含氧化铁80%的赤铁矿多少吨?
【答案】(1)98.2%
(2)1964t
【解析】
试题分析:(1)铁与盐酸反应生成氯化亚铁和氢气:Fe+2HCl ===FeCl2 +H2 ↑,生成的氢气会逸散到空气中,减少的质量即为生成的氢气的质量,故生成的氢气的质量=11.4g+30g+130g-171.1g=0.4g,依据质量守恒定律即可计算出样品中铁的质量。
设样品中铁的质量为x,
Fe + 2HCl === FeCl2 +H2 ↑
56 2
X 0.4g
56/x =2/0.4g
X=11.2g
样品中铁的质量分数=11.2g/11.4g ×100% =98.2%
(2)设需要氧化铁的质量为y,
3CO+ Fe2O3![]() 2Fe+ 3CO2
2Fe+ 3CO2
112 160
y 1120t×98.2%
160/y =112/1099.84t
Y=1571.2t
需含氧化铁80%的赤铁矿的质量=1571.2t÷80% =1964t

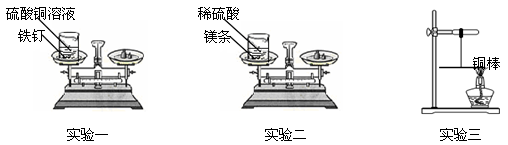
【题目】某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
【设计并实验】
实验一:将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量。然后将铁钉浸到硫酸铜溶液中,观察现象。待反应一段时间后溶液颜色改变时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验二:将盛有稀硫酸的烧杯和镁条一起放在托盘天平上称量,然后将镁条浸到稀硫酸中,观察现象。待反应一段时间后不再放出气泡时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验一和实验二的数据见下表:
编 号 | 实验一 | 实验二 |
反应前/g | 118.4 | 112.6 |
反应后/g | 118.4 | 112.4 |
实验三:用细线系住铜棒中点使之平衡,然后在铜棒一端用酒精灯加热。加热一段时间后,观察到铜棒的平衡情况是 。
【分析与讨论】
(1)在这三个实验中,你认为:实验 正确反映了反应物与生成物之间的质量关系,由此得出的结论是:在化学反应中生成物的总质量与反应物的总质量相等,请从原子的角度分析结论正确的理由是 。
(2)另外两个实验得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,你认为导致这一结论错误的原因是 (只写其中一个实验的原因即可)。
【实验反思】小组成员从不能正确反映反应物和生成物之间质量关系的两个实验中,找出了实验设计中的不当之处,并达成了以下共识:设计实验验证质量守恒定律时,对于有空气中的气体(成分)参与或有气体生成的化学反应,一般应使反应在 中进行。