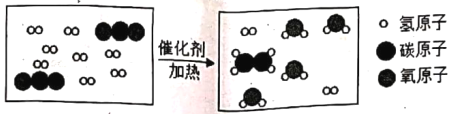
题目内容
【题目】请回答下列与金属有关的问题。
(1)为了防止月饼变质,常在月饼的内包装袋中放入一小包防腐剂,它的主要成分是铁粉,铁粉的作用是_____。
(2)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,充分反应后过滤,向滤渣中加盐酸有气泡,则滤渣中一定含有的金属是_____。
(3)为了达到收旧利废的目的,欲从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,其主要实验过程如下,请回答:
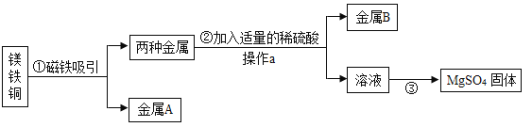
①步骤①中被磁铁吸引的金属A是_____。
②步骤③的操作是_____。
③步骤②所涉及的化学方程式为_____。
(4)冶炼2000t含杂质3%的生铁,需要含Fe3O490%的磁铁矿石的质量是_____t(结果保留至0.1)。
(5)锌粉、铝粉、镁粉的混合物8.6g与一定质量的稀硫酸恰好完全反应,经测定溶液质量仅增加了8g,将反应后的溶液蒸发水分,则得固体硫酸锌、硫酸铝、硫酸镁的混合物的质量为_____克。
【答案】与氧气和水蒸气反应 Ag、Cu、Zn 铁(或Fe) 蒸发 Mg+H2SO4=MgSO4+H2↑ 2976.7 37.4g
【解析】
(1)铁与氧气和水同时接触生成铁锈,消耗了水和氧气,不利于细菌滋生,避免月饼变质;
(2)金属活动性由强到弱为:锌>(氢)>铜>银。加入盐酸有气泡产生,说明锌有剩余,因此锌过量,可以将硝酸银和硝酸铜全部反应生成银和铜,所以滤渣为锌、铜、银三种金属混合物;
(3)①铁具有磁性,可以被磁铁吸收,因此A为铁;
②硫酸镁从溶液中制得,采用蒸发结晶方法,故步骤③的操作是蒸发;
③镁金属活动性位于氢之前,能与稀硫酸反应生成硫酸镁和氢气,化学方程式Mg+H2SO4=MgSO4+H2↑。铜金属活动性位于氢之后,不能与稀硫酸反应。
(4)磁铁矿的主要成分是四氧化三铁,设需磁铁矿质量为m,m×![]() ×100%×90%=2000t×(1-3%),m
×100%×90%=2000t×(1-3%),m![]() 2976.7t;
2976.7t;
(5)根据反应方程式Zn+H2SO4=FeSO4+H2↑;Fe+H2SO4=FeSO4+H2↑;Al+3H2SO4=Al2(SO4)3+3H2↑;可看出硫酸根与氢气是1:1的生成关系,设硫酸根为![]() ,生成氢气质量为8.6g-8g=0.6g,
,生成氢气质量为8.6g-8g=0.6g,
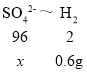
![]()
解得![]() =28.8g,
=28.8g,
因此生成溶质质量=硫酸根+金属质量=28.8g+8.6g=37.4g。

【题目】醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明,除了3%~5%的醋酸(CH3COOH)和水之外不含或极少含其他成分,请回答相应问题。
(1)白醋是____________(填“纯净物”或“混合物”),醋酸分子中氢、氧原子个数比为_____________。
(2)酿醋原理是在醋酸菌作用下乙醇(CH3CH2OH)与氧气反应,除生成醋酸外,还有另一产物,请写出该反应的化学方程式________________。
(3)某同学对白醋的性质进行如下探究。
实验操作 | 实验现象 | 实验结论与解释 |
①向白醋中滴入______ | 观察到溶液变红 | 白醋显酸性 |
②向镁粉中滴加白醋直至过量 | __________________ | 白醋能与活泼金属反应 |
③将白醋滴加到碳酸钙表面 | 有少量气泡产生 | 反应的化学方程式是_________ |
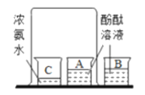
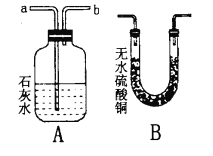
(4)若用如图装置验证水和二氧化碳两种气体生成物,应将生成的混合气体先通过_________装置,反之会有何影响?_______________。若将气体通入装置A进行验证时,气流应从_______________口通入。
【题目】水及溶液与人类的生活生产密切相关。根据下列图示,请回答相关问题。
图1活性炭净水器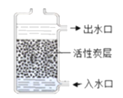 图2 水的电解
图2 水的电解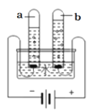
图3 溶解度曲线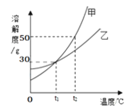 图4 探究实验
图4 探究实验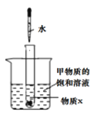
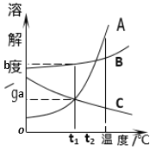
(1)图1中,活性炭净水器主要利用了活性炭具有的____性;图2所示实验中,试管b中得到的气体是(写物质名称)____。
(2)图3为甲、乙两种固体物质的溶解度曲线图。t1℃时,甲物质的溶解度是__,t2℃时,甲的饱和溶液溶质质量分数_________乙的饱和溶液溶质质量分数(填“大于”、“等于”、“小于”之一);图4所示实验中,将水滴入盛有物质X的小试管中,可观察到烧杯中有甲物质的固体析出。则物质X可能是_________(填序号之一)。
A 食盐 B 烧碱 C 生石灰 D 硝酸铵
(3)下图是氯化钠和硝酸钾在不同温度的溶解度,请回答。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①20℃时,将136g饱和NaCl溶液蒸发10g水后,再降温到20℃,可析出NaCl晶体的质量为____;
②某小组想用20%的氯化钠溶液(密度为1.17g/cm3),配制30g质量分数为10%的氯化钠溶液,需要20%的氯化钠溶液____mL
③若将上表数据在坐标系中绘制成NaCl和KNO3的溶解度曲线,两条曲线的交点对应的温度范围是___(填序号)。
A 0~20℃ B 20~40℃ C 40~60℃ D 60~80℃