题目内容
【题目】在进行稀盐酸和氢氧化钠溶液中和反应实验时,若要使反应过程中的酸碱度变化如图所示,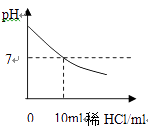
则:
(1)要得到此变化曲线,所进行的操作是(填序号)。
①将稀盐酸滴加到氢氧化钠溶液中
②将氢氧化钠溶液滴加到稀盐酸中
(2)该反应的化学方程式。
若要得到中性溶液,需借助试液,当溶液恰好中和时,现象是。
(3)当加入12mL稀盐酸后,溶液中的溶质有。
(4)实验结束后发现容器壁温度升高,证实中和反应过程中放出热量。若用固体氢氧化钠和稀硫酸反应验证中和反应过程中放出热量,你认为可行吗? , 理由是。
【答案】
(1)②
(2)NaOH+HCl=NaCl+H2O,酚酞,溶液红色消失
(3)HClNaCl
(4)不可行,因为氢氧化钠固体溶于水,也放热,温度升高
【解析】(1)溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性性,pH越大碱性越强; pH等于7,溶液呈中性;酸的溶液一定呈酸性,碱的溶液一定呈碱性;由题中信息可知,溶液的pH由大于7逐渐减小到小于7,所以是将盐酸加入氢氧化钠溶液中;
(2)氢氧化钠和盐酸的反应方程式为:NaOH+HCl=NaCl+H2O ;反应本身无明显现象,常需要借助于酸碱指示剂判断反应的发生.如果用的酸碱指示剂是酚酞试液,当溶液恰好中和时,现象是红色刚好消失;如测定溶液的pH,则刚好等于7时,两者刚好完全反应;
(3)由反应方程式可知,反应后溶液中一定有氯化钠,加入盐酸10ml时刚好完全反应,溶液中只有氯化钠;当加入12mL稀盐酸后,酸过量,溶液中的溶质有氯化钠和过量的氯化氢;
(4)若用固体氢氧化钠和稀硫酸反应,不能验证中和反应过程中放出热量,因为氢氧化钠固体溶于水放出大量的热,也会使溶液温度升高;
所以答案是:
(1)①;
(2)NaOH+HCl=NaCl+H2O;酚酞;溶液红色消失;
(3)HCl、NaCl;
(4)不可行;因为氢氧化钠固体溶于水,也放热,温度升高.
