题目内容
化学小组同学对于“金属和硫酸反应的快慢与什么因素有关”的课题开展探究[已有知识]
(1)根据金属的活动性顺序,只有排在氢(H)前面的金属才能与稀盐酸或稀硫酸反应制取氢气,且越靠 速率越快.
(2)实验室制取二氧化碳:当其他因素都相同时,稀盐酸与粉末状石灰石反应速度大于与块状石灰石速率,由此可知化学反应速率快慢与 有关.
[设计实验]下表是他们分别用相同质量的Fe丝和足量稀硫酸反应的三组实验数据:
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | Fe丝消失的时间/S |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
(4)如果实验②反应的温度改为25℃,请推出Fe丝消失的时间(用t表示)的取值范围 .
[归纳总结]影响金属和稀硫酸反应快慢的因素主要有:反应物的种类,金属颗粒大小,反应温度以及 等.
[拓展延伸]
(5)该实验除了用Fe丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量反应的快慢吗?方法:
(6)金属除了能和酸反应外还能和其他金属的盐溶液反应,已知下列各组物质间均能发生置换反应.
A.Fe和CuSO4溶液 B.Mg和MnSO4溶液 C.Mn和FeSO4溶液
①写出Fe和CuSO4溶液反应的化学方程式 .
②Mn、Fe、Mg、Cu四种金属的活动性由弱到强的顺序 .
【答案】分析:(1)根据金属的活动性顺序知识分析;
(2)根据题中信息分析化学反应速率快慢的影响因素;
(3)(4)根据对比实验的表格,变量唯一,通过变量看铁丝消失的时间分析(3)和(4);
(5)判断反应率的快慢除了观察反应物的减少速率外,还可以通过收集等量氢气所需时间来衡量反应的快慢分析;
(6)根据金属与盐的反应规律,利用Mn、Fe、Mg、Cu四种金属及其化合物间可发生的反应,推断Mn、Fe、Mg、Cu四种金属活动性由弱到强的顺序并完成解答;
解答:解:(1)根据金属的活动性顺序,只有排在氢(H)前面的金属才能与稀盐酸或稀硫酸反应制取氢气,且越靠前金属越活泼,反应速率越快.
故答案为:前;
(2)实验室制取二氧化碳时,当其他因素都相同时,稀盐酸与粉末状石灰石反应速度大于与块状石灰石速率,由此可知化学反应速率快慢与石灰石的颗粒大小有关.
故答案为:石灰石的颗粒大小;
(3)实验②和③中反应的温度不同,铁丝消失的时间不同,说明该反应快慢与温度有关,且温度越高,反应越快.
故答案为:反应的温度;
(4)根据表格中数据,20℃时,铁丝消失的时间为300秒,20℃时,铁丝消失的时间为80秒,又温度越高,反应越快,所以如果实验②反应的温度改为25℃,铁丝消失的时间(用t表示)的取值范围80<t<300;
故答案为:80<t<300;
[归纳总结]从上分析可知,影响金属和稀硫酸反应快慢的因素主要有:反应物的种类,金属颗粒大小,反应温度以及稀硫酸的溶质质量分数等;
故答案为:稀硫酸的溶质质量分数;
(5)该实验除了用铁丝消失的时间来衡量反应的快慢外,还可以通过收集等量氢气所需时间来衡量反应的快慢.
故答案为:通过收集等量氢气所需时间来衡量反应的快慢;
(6)①铁与硫酸铜反应生成了铜和硫酸亚铁,其化学方程式为:Fe+CuSO4═Cu+FeSO4;
故答案为:Fe+CuSO4═Cu+FeSO4;
②根据Fe和CuSO4溶液反应可以判断铁的活动性大于铜,根据Mg和MnSO4溶液能够反应可以判断镁的活动性大于锰,根据Mn和FeSO4溶液能反应可以判断锰的活动性大于铁,所以可以判断这四种金属的活动性由弱到强的顺序为:Cu<Fe<Mn<Mg;
故答案为:Cu<Fe<Mn<Mg.
点评:本题以实验探究的形式考查了反应物的溶质质量分数、反应温度等因素对化学反应速率的影响,重点在于培养学生的实验探究能力,同时要熟练掌握金属活动性顺序及其应用,在金属活动性顺序中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来,难度较大.
(2)根据题中信息分析化学反应速率快慢的影响因素;
(3)(4)根据对比实验的表格,变量唯一,通过变量看铁丝消失的时间分析(3)和(4);
(5)判断反应率的快慢除了观察反应物的减少速率外,还可以通过收集等量氢气所需时间来衡量反应的快慢分析;
(6)根据金属与盐的反应规律,利用Mn、Fe、Mg、Cu四种金属及其化合物间可发生的反应,推断Mn、Fe、Mg、Cu四种金属活动性由弱到强的顺序并完成解答;
解答:解:(1)根据金属的活动性顺序,只有排在氢(H)前面的金属才能与稀盐酸或稀硫酸反应制取氢气,且越靠前金属越活泼,反应速率越快.
故答案为:前;
(2)实验室制取二氧化碳时,当其他因素都相同时,稀盐酸与粉末状石灰石反应速度大于与块状石灰石速率,由此可知化学反应速率快慢与石灰石的颗粒大小有关.
故答案为:石灰石的颗粒大小;
(3)实验②和③中反应的温度不同,铁丝消失的时间不同,说明该反应快慢与温度有关,且温度越高,反应越快.
故答案为:反应的温度;
(4)根据表格中数据,20℃时,铁丝消失的时间为300秒,20℃时,铁丝消失的时间为80秒,又温度越高,反应越快,所以如果实验②反应的温度改为25℃,铁丝消失的时间(用t表示)的取值范围80<t<300;
故答案为:80<t<300;
[归纳总结]从上分析可知,影响金属和稀硫酸反应快慢的因素主要有:反应物的种类,金属颗粒大小,反应温度以及稀硫酸的溶质质量分数等;
故答案为:稀硫酸的溶质质量分数;
(5)该实验除了用铁丝消失的时间来衡量反应的快慢外,还可以通过收集等量氢气所需时间来衡量反应的快慢.
故答案为:通过收集等量氢气所需时间来衡量反应的快慢;
(6)①铁与硫酸铜反应生成了铜和硫酸亚铁,其化学方程式为:Fe+CuSO4═Cu+FeSO4;
故答案为:Fe+CuSO4═Cu+FeSO4;
②根据Fe和CuSO4溶液反应可以判断铁的活动性大于铜,根据Mg和MnSO4溶液能够反应可以判断镁的活动性大于锰,根据Mn和FeSO4溶液能反应可以判断锰的活动性大于铁,所以可以判断这四种金属的活动性由弱到强的顺序为:Cu<Fe<Mn<Mg;
故答案为:Cu<Fe<Mn<Mg.
点评:本题以实验探究的形式考查了反应物的溶质质量分数、反应温度等因素对化学反应速率的影响,重点在于培养学生的实验探究能力,同时要熟练掌握金属活动性顺序及其应用,在金属活动性顺序中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来,难度较大.

练习册系列答案
相关题目
一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.
(1)工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2,该反应的化学方程式为 ,得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属.
(2)某他学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性.
I.用甲烷和水蒸气在高温条件下反应得到合成气.根据(1)中所写的化学方程式.合成气中CO和H2的质量比为 .
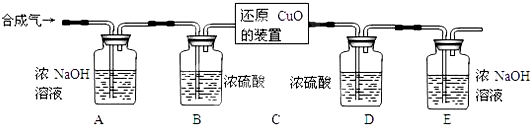
Ⅱ.用合成气还原足量氧化铜.实验装置如下图所示:

[设计买验步骤]
①连接好装置并检查气密性.
②装入药品,通人一段时间合成气.
③分别称量装置D、E的质量.
④缓缓通入合成气,加热装置C,使其充分反应.
⑤停止加热,继续通入合成气至恢复到室温.
⑥再次分别称量装置D、E的质量.
[完善实验设计]经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤 (填实验步骤的序号)中点燃(点燃前应对气体验纯).
[进行实验]该小组的同学按上述步骤进行实验,并记录了实验现象和数据:
①装置C中出现 色物质.
②称量数据如表所示.
[现象分析和数据处理]
①甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO.
②乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中可能还有未反应的CH4,且CH4也还原了CuO.试通过计算说明他的推测依据.
③丙同学提出,实验步骤⑤中通入的气体会带走装置E中的部分水蒸气,使实验产生误差.你认为该误差对乙同学的推测结果是否有影响? (选填“是”或“否”,并说明理由).
[拓展探究]该小组同学对于CH4是否真的能够还原氧化铜提出了质疑并进行探究.
查阅资料:甲烷具有还原性,可以还原氧化铜,生成CO2和H2O;白色的无水硫酸铜遇水会变成蓝色.
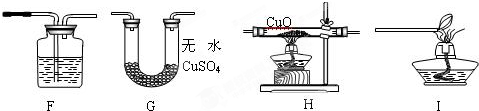
实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验.

①上图装置F中盛放的试剂名称是 .
②上图装置的正确连接顺序是 (填字母,且每套装置限用一次).
[实验反思]除了可能是CH4也还原了CuO外,出现上表数据关系还可能是因为 (写出一个原因,并说明理由).
(1)工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2,该反应的化学方程式为
(2)某他学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性.
I.用甲烷和水蒸气在高温条件下反应得到合成气.根据(1)中所写的化学方程式.合成气中CO和H2的质量比为
Ⅱ.用合成气还原足量氧化铜.实验装置如下图所示:

[设计买验步骤]
①连接好装置并检查气密性.
②装入药品,通人一段时间合成气.
③分别称量装置D、E的质量.
④缓缓通入合成气,加热装置C,使其充分反应.
⑤停止加热,继续通入合成气至恢复到室温.
⑥再次分别称量装置D、E的质量.
[完善实验设计]经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤
[进行实验]该小组的同学按上述步骤进行实验,并记录了实验现象和数据:
①装置C中出现
②称量数据如表所示.
| 装置D的质量 | 装置E的质量 | |
| 反应前 | 292.4g | 198.2g |
| 反应后 | 296.0g | 201.5g |
①甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO.
②乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中可能还有未反应的CH4,且CH4也还原了CuO.试通过计算说明他的推测依据.
③丙同学提出,实验步骤⑤中通入的气体会带走装置E中的部分水蒸气,使实验产生误差.你认为该误差对乙同学的推测结果是否有影响?
[拓展探究]该小组同学对于CH4是否真的能够还原氧化铜提出了质疑并进行探究.
查阅资料:甲烷具有还原性,可以还原氧化铜,生成CO2和H2O;白色的无水硫酸铜遇水会变成蓝色.
实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验.

①上图装置F中盛放的试剂名称是
②上图装置的正确连接顺序是
[实验反思]除了可能是CH4也还原了CuO外,出现上表数据关系还可能是因为