题目内容
(2010?房山区二模)理解、掌握质量守恒定律是学好化学的基础.(1)某同学按如图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,请你用质量守恒定律解释其原因是;发生反应的化学方程式是.
(2)由质量守恒定律可知,在化学反应前后,一定不变的是(填序号).
①分子种类 ②原子种类 ③分子数目
④原子数目 ⑤物质质量 ⑥元素种类
(3)4.14玉树地震给当地人民造成巨大损失.为防止灾后发生疫情,必须对灾区进行消毒,其中的一种消毒剂是漂白粉,它的有效成分是次氯酸钙[Ca(ClO)2],次氯酸钙能与水和二氧化碳发生反应,请完成这个反应的化学方程式:Ca(ClO)2+CO2+H2O=CaCO3↓+2.
(4)A、B、C三种物质各15g,它们化合时只生成30g新物质D.若增加10gA,则反应停止后,原反应物中只剩余B.根据上述条件推断下列说法中正确的是(填字母).
A.该反应中,B是催化剂 B.第一次反应停止后,C剩余9g
C.第二次反应后,D的质量为50g D.反应中A和B的质量比是5:2
E.反应中A和C的质量比是5:2.
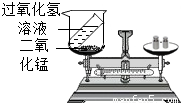
【答案】分析:(1)在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.这就叫做质量守恒定律.过氧化氢分解反应后生成H2O和O2;
(2)根据质量守恒定律,化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质的过程.在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变;
(3)根据质量守恒定律可知,在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.根据次氯酸钙与水和二氧化碳发生反应的化学方程式和质量守恒定律,就可计算出生成物各元素的原子个数与反应物各元素的原子个数之差,然后除以2,就是所缺的化学式中含有的元素的原子个数;
(4)催化剂不参与反应,根据质量守恒定律和各物质的质量关系,对选项逐一分析,即可正确选择.
解答:解:(1)根据质量守恒定律,该反应中参加反应的H2O2的质量等于反应后生成的H2O和O2的质量之和,该实验未在密闭容器中进行,O2逸散到空气中,所以天平不平衡;发生反应的化学方程式是2H2O2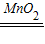 2H2O+O2↑;
2H2O+O2↑;
(2)根据质量守恒定律,在化学反应前后,一定不变的是:原子种类、原子数目、元素种类;故选:②④⑥;
(3)根据质量守恒定律和化学方程式可知,所缺的化学式中含有Ca的个数为:1-1=0,含有Cl的个数为:2÷2=1,含有C的个数为:1-1=0,含有O的个数为:(2+2+1-3)÷2=1,含有H的个数为:2÷2=1;故该化学方程式中所缺的化学式为:HClO;
(4)A、根据“若增加10gA,则反应停止后,原反应物中只剩余B”可知,A与C的质量比为(15g+10g):15g=5:3,则第一次反应停止后,C参与反应的质量为:15g÷5×3=9g,那么B参与反应的质量为:30g-15g-9g=6g;故B不是催化剂.故A不适合;
B、根据“若增加10gA,则反应停止后,原反应物中只剩余B”可知,A与C的质量比为(15g+10g):15g=5:3,则第一次反应停止后,C剩余的质量为:15g-(15g×3÷5)=6g;故B不适合;
C、根据已知条件,第一次A完全反应,生成D的质量为30g,则A与D的质量比为:15g:30g=1:2;第二次反应后,D的质量为:(10g+15g)×2=50g;故C适合;
D、根据A分析的数据可知,反应中A和B的质量比是:15g:6g=5:2;故D适合;
E、根据B分析的数据可知,反应中A和C的质量比是:15g:9g=5:3;故E不适合;
故选CD.
故答案为:(1)根据质量守恒定律,该反应中参加反应的H2O2的质量等于反应后生成的H2O和O2的质量之和,该实验未在密闭容器中进行,O2逸散到空气中,所以天平不平衡(该反应有气体生成或实验未在密闭容器中进行,答案合理给分);2H2O2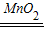 2H2O+O2↑;
2H2O+O2↑;
(2)②④⑥;
(3)HClO;
(4)CD.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
(2)根据质量守恒定律,化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质的过程.在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变;
(3)根据质量守恒定律可知,在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.根据次氯酸钙与水和二氧化碳发生反应的化学方程式和质量守恒定律,就可计算出生成物各元素的原子个数与反应物各元素的原子个数之差,然后除以2,就是所缺的化学式中含有的元素的原子个数;
(4)催化剂不参与反应,根据质量守恒定律和各物质的质量关系,对选项逐一分析,即可正确选择.
解答:解:(1)根据质量守恒定律,该反应中参加反应的H2O2的质量等于反应后生成的H2O和O2的质量之和,该实验未在密闭容器中进行,O2逸散到空气中,所以天平不平衡;发生反应的化学方程式是2H2O2
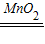 2H2O+O2↑;
2H2O+O2↑;(2)根据质量守恒定律,在化学反应前后,一定不变的是:原子种类、原子数目、元素种类;故选:②④⑥;
(3)根据质量守恒定律和化学方程式可知,所缺的化学式中含有Ca的个数为:1-1=0,含有Cl的个数为:2÷2=1,含有C的个数为:1-1=0,含有O的个数为:(2+2+1-3)÷2=1,含有H的个数为:2÷2=1;故该化学方程式中所缺的化学式为:HClO;
(4)A、根据“若增加10gA,则反应停止后,原反应物中只剩余B”可知,A与C的质量比为(15g+10g):15g=5:3,则第一次反应停止后,C参与反应的质量为:15g÷5×3=9g,那么B参与反应的质量为:30g-15g-9g=6g;故B不是催化剂.故A不适合;
B、根据“若增加10gA,则反应停止后,原反应物中只剩余B”可知,A与C的质量比为(15g+10g):15g=5:3,则第一次反应停止后,C剩余的质量为:15g-(15g×3÷5)=6g;故B不适合;
C、根据已知条件,第一次A完全反应,生成D的质量为30g,则A与D的质量比为:15g:30g=1:2;第二次反应后,D的质量为:(10g+15g)×2=50g;故C适合;
D、根据A分析的数据可知,反应中A和B的质量比是:15g:6g=5:2;故D适合;
E、根据B分析的数据可知,反应中A和C的质量比是:15g:9g=5:3;故E不适合;
故选CD.
故答案为:(1)根据质量守恒定律,该反应中参加反应的H2O2的质量等于反应后生成的H2O和O2的质量之和,该实验未在密闭容器中进行,O2逸散到空气中,所以天平不平衡(该反应有气体生成或实验未在密闭容器中进行,答案合理给分);2H2O2
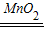 2H2O+O2↑;
2H2O+O2↑;(2)②④⑥;
(3)HClO;
(4)CD.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
(2010?房山区二模)综合实践活动小组在调查当地农业生产化肥的使用情况时,某厂生产的尿素引起了他们的兴趣,图是他们看到化肥袋上的标识说明.请阅读标识后回答:
(1)尿素属于化肥中的______;
(2)每袋尿素中有效营养元素的含量不低于______千克.(精确到0.1)
| 尿素 CO(NH2)2 国 标 GB2440-2001 含氮量≥46.3% 净 重 50±0.5kg 粒 径 0.85-2.80mm ××化肥厂 |
(2)每袋尿素中有效营养元素的含量不低于______千克.(精确到0.1)