题目内容
【题目】某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如图的实验方案:
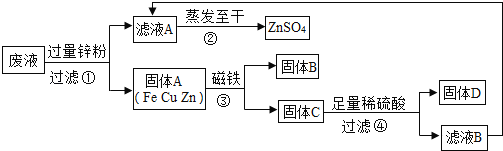
试回答:
(1)步骤①中锌粉必须过量的原因是 .
(2)写出步骤①中任一反应的化学方程式 .
(3)要检验步骤④中加入的稀硫酸是否足量的方法是 .
(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量 (填“>”、“<”或“=”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量 的质量.
【答案】(1)将废液中的Cu2+和Fe2+全部置换出来
(2)Zn+CuSO4═ZnSO4+Cu(或Zn+FeSO4=Fe+ZnSO4)
(3)取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)(4)>;固体D(或铜)
【解析】(1)因为只有加入过量的锌才会把溶液中的铁与铜置换的更彻底一些.故答案为:将废液中的Cu2+和Fe2+全部置换出来
(2)在此过程中发生了锌与硫酸铜和铁与硫酸铜的反应.故答案为:Zn+CuSO4═ZnSO4+Cu(或Zn+FeSO4=Fe+ZnSO4)
(3)步骤④中的酸是否足量主要看固体D中是否含有未反应的锌,有则酸不足量,没有则酸足量.故答案为:取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)
(4)因为反应过程中由于锌的加入而使其得到的硫酸锌质量变大了,由过程知铜的来源只有硫酸铜,则求硫酸铜的质量可利用得到铜的质量.故答案为:>;固体D(或铜)

练习册系列答案
相关题目