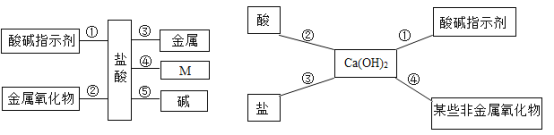
��Ŀ����
����Ŀ��Ԫ�����ڱ���ѧϰ���о���ѧ����Ҫ���ߡ�������±��ش��й����⣺
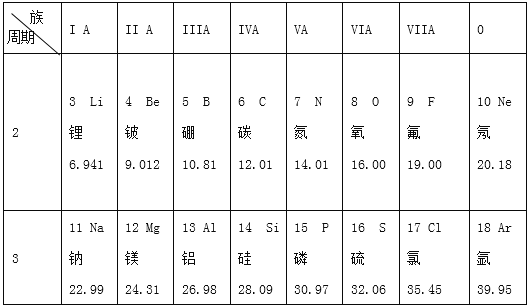
��1����֪þԭ�ӽṹʾ��ͼ��![]() �����ԭ�ӵĺ˵������_______����ԭ�ӻ�ѧ�仯����______��ѡ����õ�����ʧȥ�������ӣ��γ�_______���������ţ���M2-��Ne ��������Ų���ͬ����MԪ�ص�����Ϊ_______��
�����ԭ�ӵĺ˵������_______����ԭ�ӻ�ѧ�仯����______��ѡ����õ�����ʧȥ�������ӣ��γ�_______���������ţ���M2-��Ne ��������Ų���ͬ����MԪ�ص�����Ϊ_______��
��2����13��Ԫ�����17��Ԫ����ɵĻ�������________����д��ѧʽ�������ɸ����ʵ�����________��ѡ����ӡ�����ԭ�ӡ������ӡ�����
��3����Ԫ�����ڱ��У�ͬһ�壨���У���Ԫ�ؾ������ƵĻ�ѧ���ʡ������и���Ԫ�ؾ������ƻ�ѧ���ʵ���_________�����ţ���
a.Li��Be b.C��Si c.Si��P d.Ne��Ar
��4��ͬһ���ڴ������ң�Ԫ�صĽ������������ǽ���������ǿ����Ԫ�ع衢�ס������У��ǽ�������ǿ����________��
��5����17��Ԫ�صĵ��ʣ�˫ԭ�ӷ��ӣ�����������ˮ����ˮʱ����ɱ��������ˮ��Ӧ�������ᣨHCl���ʹ����ᣨHClO�����÷�Ӧ�Ļ�ѧ����ʽΪ___________��
��6��������ͬԭ�����͵������ķ��ӻ����ӽеȵ����壬�ȵ��������һЩ���ƵĽṹ�����ʡ����и������������ڵȵ��������_____������ĸ��ţ���
A��NO��O2 B��CO��N2 C��SO2��CO2 D��PO43����SO42��
���𰸡�12 ʧȥ Mg2+ ��Ԫ�� AlCl3 ���� bd �� Cl2+H2O=HCl+HClO BD
��������
��1������þԭ�ӽṹʾ��ͼ��֪��þԭ�ӵĺ˵����Ϊ12���������2�����ӣ��ڻ�ѧ��Ӧ����ʧȥ�������ӣ����γɴ���������λ����ɵ������ӣ�����ΪMg2+����ԭ�ӵõ�2��������Ne ��������Ų���ͬ��
��2����13��Ԫ������Ԫ�أ���17��Ԫ��Ϊ��Ԫ�أ���Ԫ����ɵĻ��������Ȼ��ƣ���ѧʽ��AlCl3�����ɸ����ʵ�����������
��3��a��Li��Beλ��ͬһ���У�����ȷ��b��C��Siλ��ͬһ���У�����ȷ��c��Si��Pλ��ͬһ���У��ʲ���ȷ��d��Ne��Arλ��ͬһ���У�����ȷ��
��4���ڹ衢�ס���������Ԫ��λ����һ���ڵ����Ҳ࣬�ǽ�������ǿ��
��5��������ˮ��Ӧ���ɴ���������ᣬ��Ӧ�Ļ�ѧ����ʽΪ��Cl2+H2O=HCl+HClO��
��6��A��һ�������������ĵ������ֱ���15��16�������ڵȵ�������B��һ����̼�͵�����ԭ�Ӹ����͵��Ӹ�������ȣ����ڵȵ�������C����������Ͷ�����̼�ĵ������ֱ���32��22�������ڵȵ�������D����������������ԭ�Ӹ����͵��Ӹ�������ȣ����ڵȵ�������