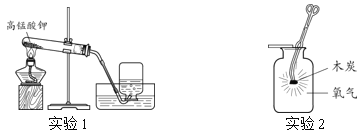
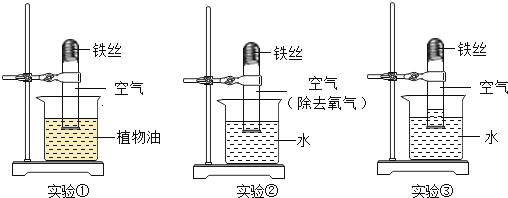
题目内容
【题目】下图为实验室保存的一瓶过氧化氢溶液的标签.某小组同学利用该溶液加水配成6%过氧化氢溶液100g,用来制取氧气.

试分析计算:
(1)在配制6%过氧化氢溶液过程中需水_____毫升;
(2)H2O2中氢元素和氧元素的质量比为_____;
(3)68克6%的过氧化氢溶液中含_____克氢元素(保留两位小数).
【答案】80 1:16 7.34
【解析】
根据溶液稀释前后的溶质质量不变;化学式和相对原子质量;元素质量的解法进行分析。
(1)设需要过氧化氢溶液的质量为x,
x×30%=100g×6%;x=20g。所以加入水的质量为100g﹣20g=80g;水的密度是1g/mL,所以水的体积是80mL;故填:80
(2)氢元素和氧元素的质量比=(2×1):(2×16)=1:16,故填:1:16
(3)氢元素质量:![]() ,故填:7.34
,故填:7.34

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案
相关题目
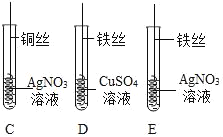
【题目】如图为某小组探究金属化学性质的两组实验。
实验I | 实验Ⅱ |
|
|
(1)实验I中以“金属表面产生气泡的快慢”为标准来判断锌铁的活动性强弱,有同学认为不够合理,理由是_____。
(2)实验Ⅱ中观察到C试管内的实验现象是_____,反应的化学方程式是_____。
(3)实验I要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是_____(填字母序号)。如果实验室只有铜片,小华将铜片分别放入两种溶液中,也通过实验验证了三种金属的活动性顺序,所用的两种溶液是_____。