题目内容
(22分)著名侯氏制碱法的重要反应之一:NH3 +CO2 +H2O+NaCl ="=" NaHCO3 +NH4Cl。在生产中,NaHCO3易结晶析出,经过滤得到NaHCO3晶体和滤液。某化学兴趣小组欲探究所得滤液中溶质的成分,及制得的纯碱样品中Na2CO3的质量分数,请你参与他们的探究活动。
【查阅资料】Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.2NaHCO3 △ Na2CO3 +CO2↑+H2O; NH4Cl △ NH3↑+HCl↑。
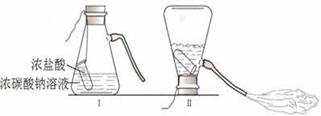
Ⅲ.NaCl溶液与AgNO3溶液反应产生不溶于稀HNO3的白色沉淀。
【探究实验1】滤液中含有的溶质是什么?
【作出猜想】猜想1:NH4Cl 猜想2:NaHCO3 猜想3:NaCl
猜想4:……
【交流与讨论】(1)化学兴趣小组认为溶质含有NaCl,理由是 。
(2)化学兴趣小组经过讨论,认为猜想4可能是 。
【实验推断】
【探究实验2】测定NaHCO3晶体受热后所得粉末中Na2CO3的质量分数。
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
(2)分析滴加的CaCl2溶液要过量的原因: 。
(3)应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算Na2CO3 的质量分数为96%。如果不洗涤沉淀物会造成测定结果大于96%,这是因为 。
【查阅资料】Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.2NaHCO3 △ Na2CO3 +CO2↑+H2O; NH4Cl △ NH3↑+HCl↑。
Ⅲ.NaCl溶液与AgNO3溶液反应产生不溶于稀HNO3的白色沉淀。
【探究实验1】滤液中含有的溶质是什么?
【作出猜想】猜想1:NH4Cl 猜想2:NaHCO3 猜想3:NaCl
猜想4:……
【交流与讨论】(1)化学兴趣小组认为溶质含有NaCl,理由是 。
(2)化学兴趣小组经过讨论,认为猜想4可能是 。
【实验推断】
| 实验步骤 | 实验现象 | 实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口。 | | 滤液中含有NH4Cl,有关化学方程式: NaOH + NH4Cl =" NaCl" + NH3↑+ H2O |
| ②另取少量滤液于试管中,滴加稀盐酸。 | 产生无色 无味气体。 | 滤液中含有 ,有关化学方程式: 。 |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液。 | 产生白色沉淀。 | 滤液中含有 ,滤液蒸干后充分灼烧的目的是 。 |
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液。 | 产生白色沉淀。 | 反应的化学方程式: 。 |
(3)应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算Na2CO3 的质量分数为96%。如果不洗涤沉淀物会造成测定结果大于96%,这是因为 。
[交流讨论] (1)NaCl没有完全反应 (2)NH4Cl 和NaHCO3的混合物(或其他合理答案均可)[实验推断]①红色变蓝色 ②NaHCO3 NaHCO3 +HCl NaCl +H2O +CO2↑ ③NaCl 除去NH4Cl [探究实验2] (1)Na2CO3 + CaCl2 CaCO3↓+2NaCl (2)使Na2CO3完全反应 (3)沉淀物中混有NaCl 和NaHCO3
试题分析:【交流与讨论】(1)氯化钠是反应物之一,如没有完全参与反应,则溶质中应含有NaCl。
(2)氯化铵没有析出、碳酸氢钠可溶解一部分,所以可能为氯化铵和碳酸氢钠的混合物。
【实验推断】①氯化铵可与碱反应生成氨气,氨气溶于水呈碱性,可使红色石蕊试液变蓝。
②碳酸氢钠可与盐酸反应生成二氧化碳气体,所以知滤液中有碳酸氢钠。反应的化学方程式为:NaHCO3 +HCl NaCl +H2O +CO2↑
③“滴加稀HNO3,再滴加AgNO3溶液,产生白色沉淀”说明沉淀为氯化银。则原滤液中含有氯离子,即含氯化钠。滤液蒸干后充分灼烧可除去氯化铵,防止对实验造成影响。
【探究实验2】(1)碳酸钠可与氯化钙溶液的反应生成碳酸钙沉淀,反应的化学方程式为:Na2CO3 + CaCl2 CaCO3↓+2NaCl
(2)滴加的CaCl2溶液要过量是为了使碳酸钠完全反应,以免影响测定碳酸钠的质量。
(3)沉淀物中混有NaCl 和NaHCO3,二者可溶解于水,可利用洗涤的方法除去。如不洗涤,则会沉淀的质量偏大,进一步计算出碳酸钠的质量分数偏大。

练习册系列答案
相关题目