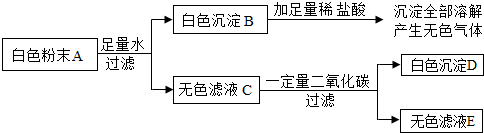
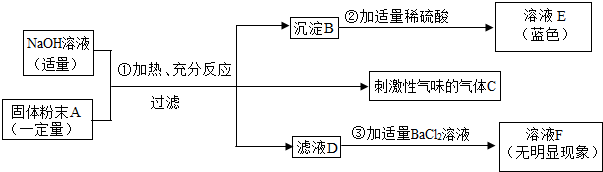
题目内容
有一包绿色粉末A,进行化学分析如下,将绿色粉末A加热得无色气体B,无色液体C和黑色固体D.(1)将气体B通入澄清石灰水,有白色沉淀E生成;(2) 将C滴到无水硫酸铜上,生成蓝色晶体F;(3)将氢气通过D并加热,有红色固体G生成,将稀硫酸加入盛有D的烧杯微热,D溶解,再加NaOH溶液,有蓝色 沉淀H生成.根据上述反应现象,推断:A、B、C、D、E、F、G、H各是什么物质,用化学式表示:
A ______B ______C ______D ______E ______F ______G ______H ______
解:绿色粉末A为铜绿,受热时能分解生成无色气体B二氧化碳、无色液体C水和黑色粉末D氧化铜;二氧化碳通入澄清石灰水生成白色碳酸钙沉淀E;把水滴到无水硫酸铜上,可生成蓝色晶体硫酸铜晶体F;在加热条件下氢气和黑色氧化铜可生成红色G物质铜,且氧化铜能与稀硫酸反应生成硫酸铜,生成的硫酸铜与氢氧化钠反应生成蓝色氢氧化铜沉淀H;
综上所述,物质A为铜绿Cu2(OH)2CO3,物质B为二氧化碳CO2,物质C为水H2O,物质D为氧化铜CuO,物质E为碳酸钙CaCO3,物质F为硫酸铜晶体CuSO4?5H2O,物质G为铜Cu,物质H为氢氧化铜Cu(OH)2.
故答案为:Cu2(OH)2CO3;CO2;H2O;CuO;CaCO3;CuSO4?5H2O;Cu;Cu(OH)2.
分析:绿色粉末为碱式碳酸铜俗称铜绿,能使澄清石灰水变浑浊的气体为二氧化碳气体,白色硫酸铜粉末遇水变成蓝色硫酸铜晶体,蓝色沉淀为氢氧化铜,红色金属单质为铜,黑色金属氧化物有氧化铜和四氧化三铁;铜绿受热分解生成氧化铜、水和二氧化碳;氢气在加热条件下能与金属氧化物反应生成金属单质和水;金属氧化物能与酸反应生成盐和水;
利用以上物质的特性及物质间的反应规律,根据实验中所出现的现象,对实验过程中所涉及的物质进行推断,并写出各物质的化学式.
点评:利用物质的特殊性质及变化的规律,根据实验中所观察到的现象,对实验中所涉及的物质进行推断.
综上所述,物质A为铜绿Cu2(OH)2CO3,物质B为二氧化碳CO2,物质C为水H2O,物质D为氧化铜CuO,物质E为碳酸钙CaCO3,物质F为硫酸铜晶体CuSO4?5H2O,物质G为铜Cu,物质H为氢氧化铜Cu(OH)2.
故答案为:Cu2(OH)2CO3;CO2;H2O;CuO;CaCO3;CuSO4?5H2O;Cu;Cu(OH)2.
分析:绿色粉末为碱式碳酸铜俗称铜绿,能使澄清石灰水变浑浊的气体为二氧化碳气体,白色硫酸铜粉末遇水变成蓝色硫酸铜晶体,蓝色沉淀为氢氧化铜,红色金属单质为铜,黑色金属氧化物有氧化铜和四氧化三铁;铜绿受热分解生成氧化铜、水和二氧化碳;氢气在加热条件下能与金属氧化物反应生成金属单质和水;金属氧化物能与酸反应生成盐和水;
利用以上物质的特性及物质间的反应规律,根据实验中所出现的现象,对实验过程中所涉及的物质进行推断,并写出各物质的化学式.
点评:利用物质的特殊性质及变化的规律,根据实验中所观察到的现象,对实验中所涉及的物质进行推断.

练习册系列答案
相关题目