题目内容
(2012?白下区一模)有一包白色粉末A,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成.为探究其组成,进行如下实验(实验流程如图):
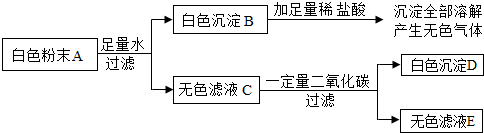
(1)取白色粉末A,向其中加入足量水,充分搅拌后过滤,得到白色沉淀B和无色滤液C.由此可判断,原白色粉末中一定不含有
(2)向白色沉淀B中加入足量稀盐酸,沉淀全部溶解,并产生无色气体.由此可判断,原白色粉末中一定含有
(3)向无色滤液C中通入一定量二氧化碳,充分反应后过滤,得到白色沉淀D和无色滤液E,由此可判断,原白色粉末中一定还含有
(4)若流程图中白色粉末A为20g,白色沉淀D为9.85g,无色滤液E中只含一种溶质.
①无色滤液E中的溶质为
②通过计算确定20g白色粉末A中所含各物质的质量.(请写出计算及推理过程)

(1)取白色粉末A,向其中加入足量水,充分搅拌后过滤,得到白色沉淀B和无色滤液C.由此可判断,原白色粉末中一定不含有
CuSO4
CuSO4
.(2)向白色沉淀B中加入足量稀盐酸,沉淀全部溶解,并产生无色气体.由此可判断,原白色粉末中一定含有
CaCO3
CaCO3
.(3)向无色滤液C中通入一定量二氧化碳,充分反应后过滤,得到白色沉淀D和无色滤液E,由此可判断,原白色粉末中一定还含有
BaCl2和NaOH
BaCl2和NaOH
.(4)若流程图中白色粉末A为20g,白色沉淀D为9.85g,无色滤液E中只含一种溶质.
①无色滤液E中的溶质为
NaCl
NaCl
;②通过计算确定20g白色粉末A中所含各物质的质量.(请写出计算及推理过程)
分析:(1)硫酸铜溶于水得到的是蓝色溶液,可以据此判断该题;
(2)硫酸钡不溶于酸,所以根据白色沉淀全部溶解,可以判断该白色沉淀为碳酸钙,可以据此作答;
(3)通入二氧化碳产生了白色沉淀,根据二氧化碳的性质可以判断该混合物中还含有氢氧化钠和氯化钡;
(4)根据上述分析及题给的条件可以判断出反应为:二氧化碳和氢氧化钠反应生成了碳酸钠,然后氯化钡和碳酸钠的反应,所以最后得到的溶液为氯化钠溶液,可以据此解答该题.
(2)硫酸钡不溶于酸,所以根据白色沉淀全部溶解,可以判断该白色沉淀为碳酸钙,可以据此作答;
(3)通入二氧化碳产生了白色沉淀,根据二氧化碳的性质可以判断该混合物中还含有氢氧化钠和氯化钡;
(4)根据上述分析及题给的条件可以判断出反应为:二氧化碳和氢氧化钠反应生成了碳酸钠,然后氯化钡和碳酸钠的反应,所以最后得到的溶液为氯化钠溶液,可以据此解答该题.
解答:解:(1)由得到溶液为无色溶液可以判断该白色粉末中没有硫酸铜,因为硫酸铜溶于水得到的是蓝色溶液;
(2)因为硫酸钡不溶于水也不溶于酸,所以可以判断该白色粉末中硫酸钠和氯化钡至少有一种不存在,由于生成了气体,所以可以判断该白色沉淀中含有碳酸钙;
(3)向滤液C中加入二氧化碳生成了白色沉淀,而二氧化碳不能和氯化钡反应,所以可以判断该物质在还含有氢氧化钠,而白色沉淀是二氧化碳和氢氧化钠反应后生成的碳酸钠,然后碳酸钠和氯化钡反应生成碳酸钡沉淀;
(4)①根据(3)的解答可以知道最后所得到的滤液为氯化钠溶液;
②由最后所得到的滤液为氯化钠溶液,可以知道所给的物质均已完全反应,
设氢氧化钠的质量为x,氯化钡的质量为y,所发生的反应为:
CO2+2NaOH═Na2CO3+H2O,Na2CO3+BaCl2═BaCO3↓+2NaCl,联立两个方程式可以得出关系式如下:
2NaOH-BaCl2-BaCO3↓
80 208 197
x y 9.85g
=
=
解得:x=4g,y=10.4g
所以碳酸钙的质量为:20g-10.4g-4g=5.6g;
答:通过计算确定20g白色粉末A中所含氯化钡的质量为10.4g,氢氧化钠的质量为4g,碳酸钙的质量为5.6g.
故答案为:(1)CuSO4;
(2)CaCO3;
(3)BaCl2和NaOH;
(4)①NaCl;②BaCl2的质量为10.4g;NaOH的质量为4g;CaCO3的质量为5.6g.
(2)因为硫酸钡不溶于水也不溶于酸,所以可以判断该白色粉末中硫酸钠和氯化钡至少有一种不存在,由于生成了气体,所以可以判断该白色沉淀中含有碳酸钙;
(3)向滤液C中加入二氧化碳生成了白色沉淀,而二氧化碳不能和氯化钡反应,所以可以判断该物质在还含有氢氧化钠,而白色沉淀是二氧化碳和氢氧化钠反应后生成的碳酸钠,然后碳酸钠和氯化钡反应生成碳酸钡沉淀;
(4)①根据(3)的解答可以知道最后所得到的滤液为氯化钠溶液;
②由最后所得到的滤液为氯化钠溶液,可以知道所给的物质均已完全反应,
设氢氧化钠的质量为x,氯化钡的质量为y,所发生的反应为:
CO2+2NaOH═Na2CO3+H2O,Na2CO3+BaCl2═BaCO3↓+2NaCl,联立两个方程式可以得出关系式如下:
2NaOH-BaCl2-BaCO3↓
80 208 197
x y 9.85g
| 80 |
| x |
| 208 |
| y |
| 197 |
| 9.85g |
解得:x=4g,y=10.4g
所以碳酸钙的质量为:20g-10.4g-4g=5.6g;
答:通过计算确定20g白色粉末A中所含氯化钡的质量为10.4g,氢氧化钠的质量为4g,碳酸钙的质量为5.6g.
故答案为:(1)CuSO4;
(2)CaCO3;
(3)BaCl2和NaOH;
(4)①NaCl;②BaCl2的质量为10.4g;NaOH的质量为4g;CaCO3的质量为5.6g.
点评:本题属于文字叙述型推断题,在给定的物质范围和实验现象,来推出混合物中一定存在、一定不存在和可能存在的是什么物质;解答时以文字信息为序,寻找并抓住“题眼”,逐步分析“筛选”最终得出答案即可.

练习册系列答案
相关题目
 (2012?白下区一模)把某稀硫酸分为等体积的两份,分别加入等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),反应后金属都没有剩余,产生H2的质量随时间变化的趋势如图.下列说法正确的是( )
(2012?白下区一模)把某稀硫酸分为等体积的两份,分别加入等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),反应后金属都没有剩余,产生H2的质量随时间变化的趋势如图.下列说法正确的是( ) (2012?白下区一模)两种不含结晶水的固体物质a、b的溶解度曲线如图,下列说法正确的是( )
(2012?白下区一模)两种不含结晶水的固体物质a、b的溶解度曲线如图,下列说法正确的是( )