题目内容
【题目】下列装置常用于实验室制取气体。请根据给出的装置回答下列问题:

(1)写出仪器①的名称_____。
(2)实验室用氯酸钾制取氧气,应选用的发生装置是___(填序号),化学方程式是____。
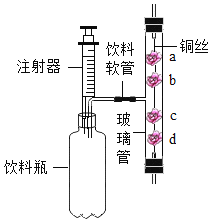
(3)用B和E装置制取并收集CO2,反应的化学方程式为____。选择装置B作为制取CO2气体的发生装置,其突出优点是____,若改用F装置收集二氧化碳,则气体应从_____(填“a”或“b”)端进入。制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用G、H装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→____→____→___→____(用导气管端口字母表示)。
【答案】长颈漏斗 A 2KClO3 ![]() 2KCl+3O2 ↑ CaCO3+2HCl=CaCl2+CO2+H2O 可以控制反应的发生和停止 b e f c d
2KCl+3O2 ↑ CaCO3+2HCl=CaCl2+CO2+H2O 可以控制反应的发生和停止 b e f c d
【解析】
(1)仪器①的名称为:长颈漏斗;
(2)用氯酸钾制氧气,反应物是固体,反应条件是加热,发生装置可选用A;氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式为:2KClO3 ![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)实验室制取CO2,是在常温下用大理石或石灰石和稀盐酸制取的,大理石或石灰石的主要成分是碳酸钙,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2+H2O;选择装置B作为制取CO2气体的发生装置时,大理石或石灰石放在多孔隔板上,稀盐酸从长颈漏斗中加入。反应开始后,关闭开关,气体不能导出,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止;打开开关,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。装置B的优点是:可以控制反应的发生和停止;二氧化碳的密度比空气大,若改用F装置收集二氧化碳,则气体应从b进入;制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,要先用NaHCO3溶液除去氯化氢气体(NaHCO3溶液能与氯化氢气体反应生成氯化钠、水和二氧化碳)再通过浓硫酸洗气瓶除去水蒸气(浓硫酸具有吸水性),在除去氯化氢和水蒸气时,为了使气体与试剂充分接触,气体应从长管进短管出。装置正确的连接顺序是:混合气体→e→f→c→d。

【题目】全国人大和政协会议使用了一种含碳酸钙的“石头纸”。为测定其中碳酸钙(杂质不溶于水,也不与盐酸反应)的含量,某小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5g样品研碎放入烧杯中,每次加入20.8g稀盐酸后并用电子天平称量,记录实验数据如表:
加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
烧杯及所称物质总质量/g | 82.2 | 101.9 | 121.6 | 141.3 | 162.1 |
(1)“石头纸”中碳酸钙的质量分数为_____
(2)求恰好完全反应时烧杯内溶液中溶质的质量分数____(写出计算过程)