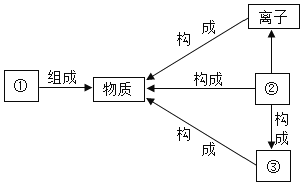
题目内容
【题目】某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如下:
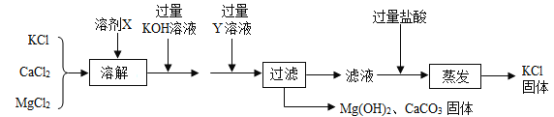
请认真分析流程中各步骤的信息作答:
(1)溶剂X是水,写出加入过量KOH溶液反应的化学方程式_____;
(2)加入过量Y溶液发生反应的化学方程式为_________;
(3)每一步试剂加入的量是“过量”,原因是_____,过量盐酸会不会影响KCl的纯度,写出结论并分析原因______。
【答案】![]()
![]() 使杂质氯化镁和氯化钙充分反应被除去 不会影响KCl的纯度,原因是在蒸发时,盐酸中的氯化氢会逸出
使杂质氯化镁和氯化钙充分反应被除去 不会影响KCl的纯度,原因是在蒸发时,盐酸中的氯化氢会逸出
【解析】
(1)加水溶解后,溶液中含有的溶质是氯化钾、氯化钙和氯化镁,加入过量KOH溶液,氯化镁会与其充分反应生成沉淀氢氧化镁和氯化钾,所以反应的化学方程式为:![]() 。故填:
。故填:![]() 。
。
(2)加入过量Y溶液的目的是除去氯化钙杂质,碳酸钾溶液能与氯化钙反应生成碳酸钙沉淀和氯化钾,将钙离子转化为沉淀,发生反应的化学方程式为:![]() 。故填:
。故填:![]() 。
。
(3)加入的水过量是为了充分溶解,而加入的氢氧化钾和碳酸钾溶液过量是为了将杂质氯化镁和氯化钙充分反应转化为沉淀除去;加入过量盐酸是为了将过量的氢氧化钾和碳酸钾溶液转化为氯化钾。最后过量的盐酸在蒸发过程中,溶质氯化氢会变为气体挥发出去,不会影响KCl的纯度。故填:不会影响KCl的纯度,原因是在蒸发时,盐酸中的氯化氢会逸出

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
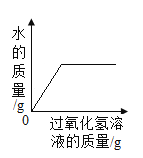
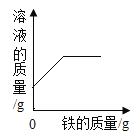
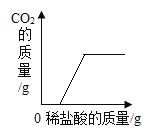
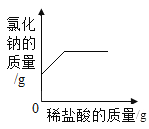
小学生10分钟应用题系列答案【题目】下列4个坐标图分别表示4个实验过程中某些物质质量的变化,其中正确的是()
A | B | C | D |
向一定量二氧化锰中滴加过氧化氢溶液 | 向一定量硫酸铜溶液中不断加入铁粉 | 向一定量大理石中滴加稀盐酸 | 向一定量氯化钠和碳酸氢钠混合物中滴加稀盐酸 |
|
|
|
|
A.AB.BC.CD.D
【题目】甲、乙、内三种物质的转化关系见下面如图所示,“→”表示反应可以一步实现(部分物质和反应条件已省略),下面选项中不能按图示转化关系实现的是( )
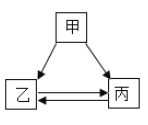
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | NaOH | NaCl | NaNO3 |
C | Na2O | NaOH | Na2CO3 |
D | Ca(OH)2 | CaCl2 | CaCO3 |
A. AB. BC. CD. D