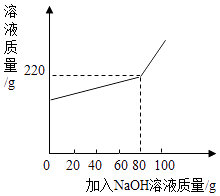
题目内容
【题目】如图是密封容器中某反应的微观示意图,“ ![]() ”、“
”、“ ![]() ”表示不同种元素的原子.
”表示不同种元素的原子. 
(1)反应前后方框内应再填入1个微粒(填序号),判断依据是 A、 ![]() B、
B、 ![]() C、
C、 ![]()
(2)该反应属于反应(填基本反应类型)
(3)写出符合图中微观所示的一个具体反应的化学方程式 .
【答案】
(1)C;质量守恒定律
(2)分解
(3)2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】解:(1)由质量守恒定律反应前后原子的种类及数目不变可知,反应前后方框内应再填入1个 ![]() .(2)该反应由一种物质生成了两种物质,属于分解反应;(3)由微粒的构成、反应的微粒的数目关系可知,水通电分解生成氢气和氧气符合图中微观所示的反应,反应的化学方程式为:2H2O
.(2)该反应由一种物质生成了两种物质,属于分解反应;(3)由微粒的构成、反应的微粒的数目关系可知,水通电分解生成氢气和氧气符合图中微观所示的反应,反应的化学方程式为:2H2O ![]() 2H2↑+O2↑.
2H2↑+O2↑.
故答为:(1)C;(2)分解;(3)2H2O ![]() 2H2↑+O2↑.
2H2↑+O2↑.
(1)根据质量守恒定律分析应补充的微粒;(2)根据反应的特点分析反应的类型;(3)根据微粒的构成、反应的微粒的数目关系等分析符合图中微观所示的一个具体反应的化学方程式.

【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,如图1,其中蛋壳的主要成分是CaCO3 , 里面覆盖一层蛋壳膜.我校兴趣小组的同学为此开展了以下探究活动: 
(1)【提出问题1】 鸡蛋白中主要的营养成分是;
(2)【查阅资料】 a、CaCO3灼烧分解生成氧化钙和一种无毒的氧化物.
b、蛋壳中的其它成分不参加反应.
c、NaHCO3+HCl═NaCl+H2O+CO2↑,Ba(OH)2+CO2═BaCO3↓+H2O,
d、已知仪器a装有10%的稀盐酸,其他成分均不与HCl反应,装置内试剂均足量.
【提出问题2】
蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定.请你参与他们的探究.
【设计方案】他们分别称取12.0g蛋壳设计了以下不同的实验方案:
小华的方案:
称取12.0g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g.则:减少的质量是(填化学式)的质量,经计算得蛋壳中的CaCO3的质量分数为91.7%.
(3)小明的方案:小明设计了如图2所示的实验装置. 【实验步骤】
①按图2连接好装置后,并;
②向B装置中加入蛋壳样品后,先通入空气一会儿;
③接下来的实验操作是 , 直到为止(填实验现象);
④再通入空气一会儿,至装置C中不再产生沉淀为止;
⑤将装置C中的固液混合物过滤、洗涤、烘干后称量其质量;
⑥重复上述实验.
(4)【实验数据】重复实验,3次数据记录如表:
实验次数 | 实验1 | 实验2 | 实验3 |
装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
【实验分析及数据整理】
② 上述数据能否用托盘天平称量 . (填“能”或“不能”)
②若无A装置,直接通入空气,则测定结果将 . (填“偏大”、“偏小”或“不变”)
③实验重复3次的目的是 .
④请利用3次实验数据的平均值,计算该蛋壳中的CaCO3质量分数 .
(5)【实验反思】 下列各项措施中,能提高小明测定准确度的是(填序号).
Ⅰ.在装置A、B之间增加盛有浓硫酸的洗气瓶
Ⅱ.缓缓滴加稀盐酸
Ⅲ.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶.