题目内容
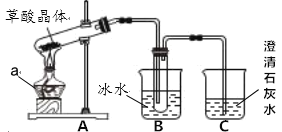
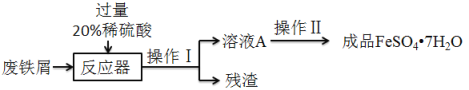
【题目】废铁屑的主要成分是铁,同时还有少量铁锈(主要成分是Fe2O3)等杂质,动物饲料硫酸亚铁的生产工艺之一如图所示:
(1)实验室欲用98%的浓硫酸(密度1.84g/mL)配制200g20%的稀硫酸,有以下实验步骤:
a.量取 b.计算 c.稀释 d.装瓶贴标签
正确的顺序是_____(填字母)。若用量筒量取浓硫酸时俯视读数,其他操作正确,则所得溶液的质量分数_____20%(填“>”“<”或“=”)。
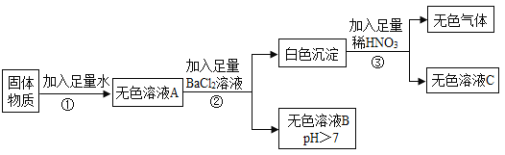
(2)在反应器中反生的化学反应①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;②Fe2(SO4)3+Fe=3FeSO4;③_____。
(3)溶液A中的溶质是_____(填化学式)。
(4)操作Ⅰ的名称是_____,完成操作Ⅰ的玻璃仪器有:玻璃棒、烧杯和_____。
(5)经过操作Ⅱ:蒸发浓缩、_____、过滤、冰水洗涤、低温干燥可得硫酸亚铁晶体(FeSO47H2O),用低温干燥说明硫酸亚铁晶体可能具有的性质是_____。
【答案】bacd < Fe+H2SO4=FeSO4+H2↑ FeSO4、H2SO4 过滤 漏斗 降温结晶 受热易分解(或受热不稳定或受热易发生化学变化等)
【解析】
(1)实验室欲用98%的浓硫酸(密度为1.84g/mL)配制200g20%的稀硫酸,实验步骤:计算、量取、稀释和装瓶贴标签。所以正确的顺序是 bacd.若用量筒量取浓硫酸时俯视读数,则量取的液体偏少,即溶质偏少,则所得溶液的质量分数<20%。
(2)在反应器得到的生成物最终得到硫酸亚铁,所以过程中氧化铁和硫酸反应生成硫酸铁和水,而硫酸铁和铁反应生成硫酸亚铁,还可以有铁和硫酸反应生成硫酸亚铁和氢气,所以发生的化学反应①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;②Fe2(SO4)3+Fe=3FeSO4;③Fe+H2SO4=FeSO4+H2↑
(3)由于在反应器得到的生成物最终得到硫酸亚铁且加入的硫酸过量,所以溶液A中的溶质是 H2SO4、FeSO4。
(4)操作I实现了固体和液体分离,为过滤,完成操作I的玻璃仪器有:玻璃棒、烧杯和 漏斗。
(5)经过操作Ⅱ:蒸发浓缩 降温结晶、过滤、冰水洗涤、低温干燥可得硫酸亚铁晶体(FeSO47H2O),用低温干燥说明硫酸亚铁晶体可能具有的性质是 热不稳定或者受热易分解。
故答案为:
(1)bacd;<。
(2)①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;②Fe2(SO4)3+Fe=3FeSO4;或者Fe+H2SO4=FeSO4+H2↑;
(3)H2SO4、FeSO4。
(4)过滤;漏斗。
(5)降温结晶;热不稳定或者受热易分解。

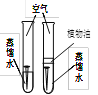
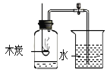
【题目】某同学用如图所示装置.分别进行“燃烧条件”和“氧气性质”的探究实验(已知:白磷的着火点为40℃)。请回答下列问题:
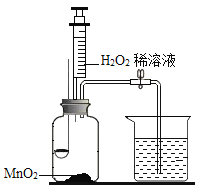
内容步骤 | (实验1)燃烧条件 | (实验2)氧气性质 |
1 | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞; | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭,点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞; |
2 | 推入H2O2溶液 | 推入H2O2溶液 |
(1)H2O2与MnO2接触时,发生反应的化学方程式为___________________,MnO2起_________作用。
(2)实验1中,推入H2O2溶液,燃烧匙和水中的白磷均不燃烧,原因分别是___、____;打开止水夹,推入H2O2溶液,观察到烧杯中的现象是_______。
(3)实验2中打开止水夹,推入H2O2溶液,观察到木炭燃烧得更剧烈,由此得出氧气的性质是_______,木炭熄灭冷却一段时间后,烧杯中的部分溶液流入集气瓶,该实验开始时到实验结束后,集气瓶内压强的变化过程是___________。