题目内容
化学是研究物质组成、结构、性质及其变化规律的科学.下列图甲、图乙分别表示两个反应的微观示意图.
图甲中 表示氯原子
表示氯原子 表示钠原子
表示钠原子 表示氧原子
表示氧原子
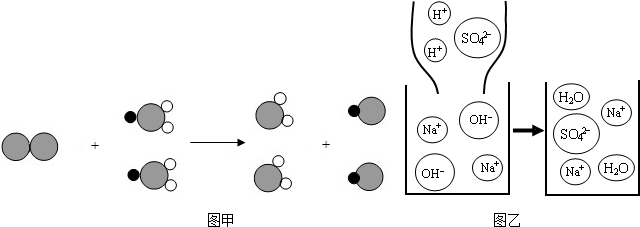
(1)根据图甲反应的微观示意图,写出该反应的化学方程式______.请从粒子的角度解释质量守恒定律______.
(2)图乙是稀硫酸和氢氧化钠溶液反应的微观示意图.请从粒子的角度具体分析该反应能发生的原因______.
(3)某同学通过图甲反应得出:化学反应从微观上是分子和原子的破裂,然后重新组合生成新分子的过程.你是否同意他的说法?为什么?______.
解:(1)由图甲可得知,反应前有一个由2个Cl原子构成的Cl2分子、两个由1个Na原子与1个Cl原子和2个O原子构成的NaClO2分子,而反应后有两个由1个Cl原子和2个O原子构成的ClO2分子、两个由1个Na原子和12个Cl原子构成的NaCl分子,因此该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl;
对比该变化前后,可得知:变化前有Na、Cl、O三种原子而变化后仍为这三种原子,变化前后原子种类不变;变化前有2个Na原子、4个Cl原子和4个O原子,变化后各种原子个数仍为2、4、4,变化前后原子的个数不变;因此变化前后物质的质量总和相等;
故答案为:Cl2+2NaClO2═2ClO2+2NaCl;在化学反应前后,原子的种类、原子的数目及原子的质量都没有改变;
(2)由图乙可得知:变化前有四种微粒Na+、OH-、H+、SO42-,而变化后的微粒为Na+、SO42-、H2O;因此,可判断该反应的发生实质为H+与OH-生成H2O的过程;
故答案为:氢离子和氢氧根离子结合成水分子;
(3)对比图甲,变化前有Na、Cl、O三种原子而变化后仍为这三种原子,变化前后原子种类不变;变化前有2个Na原子、4个Cl原子和4个O原子,变化后各种原子个数仍为2、4、4,变化前后原子的个数不变;而变化前的分子为Cl2、NaClO2,变化后分子为ClO2、NaCl;因此,变化前后分子发生改变而原子不变;
故答案为:不同意,因为在化学反应中只有分子破裂,原子不破裂.
分析:(1)根据图甲反应的微观示意图,可由构成物质的分子结构图判断反应中的物质为Cl2和NaClO2发生反应生成ClO2和NaCl;并且通过对比变化前后的微粒,可发现变化前后分子发生了改变,但构成分子的原子不变;
(2)对比图乙变化前后的微粒,可得出变化是由于氢离子和氢氧根离子生成水分子而发生的;
(3)对比图甲变化前后的微粒,变化前后的分子构成发生了改变,但构成分子的原子种类和个数没有改变.
点评:根据微粒的构成的差别,通过对比变化前后微粒的改变,得出变化的特点和规律,这是解决此题的基本方法.
对比该变化前后,可得知:变化前有Na、Cl、O三种原子而变化后仍为这三种原子,变化前后原子种类不变;变化前有2个Na原子、4个Cl原子和4个O原子,变化后各种原子个数仍为2、4、4,变化前后原子的个数不变;因此变化前后物质的质量总和相等;
故答案为:Cl2+2NaClO2═2ClO2+2NaCl;在化学反应前后,原子的种类、原子的数目及原子的质量都没有改变;
(2)由图乙可得知:变化前有四种微粒Na+、OH-、H+、SO42-,而变化后的微粒为Na+、SO42-、H2O;因此,可判断该反应的发生实质为H+与OH-生成H2O的过程;
故答案为:氢离子和氢氧根离子结合成水分子;
(3)对比图甲,变化前有Na、Cl、O三种原子而变化后仍为这三种原子,变化前后原子种类不变;变化前有2个Na原子、4个Cl原子和4个O原子,变化后各种原子个数仍为2、4、4,变化前后原子的个数不变;而变化前的分子为Cl2、NaClO2,变化后分子为ClO2、NaCl;因此,变化前后分子发生改变而原子不变;
故答案为:不同意,因为在化学反应中只有分子破裂,原子不破裂.
分析:(1)根据图甲反应的微观示意图,可由构成物质的分子结构图判断反应中的物质为Cl2和NaClO2发生反应生成ClO2和NaCl;并且通过对比变化前后的微粒,可发现变化前后分子发生了改变,但构成分子的原子不变;
(2)对比图乙变化前后的微粒,可得出变化是由于氢离子和氢氧根离子生成水分子而发生的;
(3)对比图甲变化前后的微粒,变化前后的分子构成发生了改变,但构成分子的原子种类和个数没有改变.
点评:根据微粒的构成的差别,通过对比变化前后微粒的改变,得出变化的特点和规律,这是解决此题的基本方法.

练习册系列答案
相关题目
 表示氯原子
表示氯原子 表示钠原子
表示钠原子 表示氧原子
表示氧原子
 化学是研究物质组成、结构、性质及其变化规律的科学.请回答下列问题:
化学是研究物质组成、结构、性质及其变化规律的科学.请回答下列问题: