题目内容
小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验.【第一组实验】检验该双氧水是否失效.
(1)实验过程
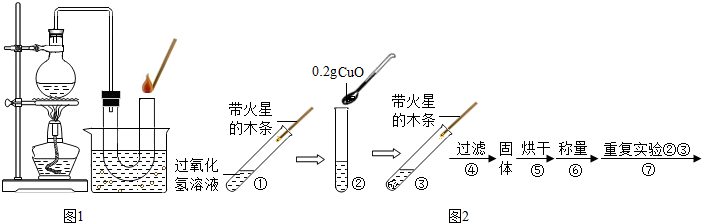
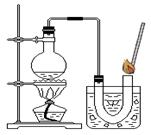
①在试管中加入5mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
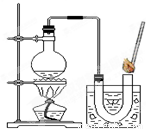
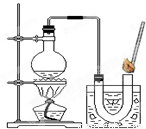
③如图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是______.
(2)实验结论:______.
【第二组实验探究】:氧化铜(CuO)能否催化“双氧水”分解
[猜想]Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是反应的催化剂,反应前后______.
[实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验:
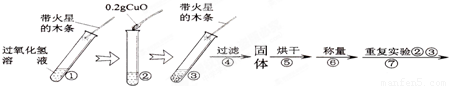
(3)完成下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中______, 带火星的木条复燃. | ______ | 溶液中有气泡放出, ______. | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立. |
(5)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗(带滤纸)、烧杯、______.
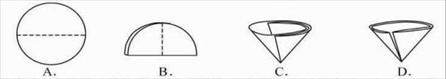
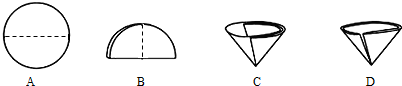
(6)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号).
(7)步骤⑦的目的______
(8)过氧化氢能被CuO催化分解放出O2的反应表达式为______
(2)根据实验现象可以得出实验结论;
【第二组实验】(1)根据催化剂的性质分析;
(3)①根据实验结论分析,并结合过氧化氢分解的反应原理和氧气的性质及催化剂的性质来解答;
(4)根据实验现象进行分析;
(5)根据过滤使用仪器来解答;
(6)根据滤纸的折叠方法进行选择;
(7)根据实验目的进行分析;
(8)根据过氧化氢分解的反应原理解答;
【第三组实验】(9)根据实验装置进行分析;
(10)双氧水分解放热,生成的水会汽化,影响测量值,所以冰水的作用是除去氧气中的水蒸气;实验时气体收集在量气管中.若要保证读取的气体体积没有误差,在反应后读数前应进行的操作是:上下移动水准瓶使两边液面相平;
(11)为减小误差,所选择的量气管应与生成气体的体积相近;
(12)由实验现象推导结论;
【拓展研究】根据化合物中某元素的质量和方程式进行计算.
解答:解:【第一组实验】
(1)③在加热时水会气化,可能干扰实验现象,所以冰水的作用是让水蒸气冷凝;
(2)根据第③步中带火星的木条复燃,可以得出该过氧化氢没有失效;
【第二组实验】(1)催化剂的质量和化学性质反应前后不变;
(3)根据实验结论猜想Ⅲ成立,说明氧化铜是过氧化氢分解的催化剂,所以③中加入氧化铜后会迅速生成大量氧气,有气泡产生,催化剂能改变物质的化学反应速率,而本身的质量和化学性质不变,所以过滤后称量质量不变,且化学性质不变,仍能对过氧化氢溶液起到催化作用;
(4)用手接触试管底部,感觉烫手.说明“双氧水”分解放热;
(5)过滤用到的仪器有烧杯、铁架台、漏斗、玻璃棒;
(6)过滤时将圆形滤纸对折两次,所以D错误;
(7)已经验证了二氧化锰能加快改反应速率和质量不变,但还没有验证二氧化锰的化学性质在反应前后是否改变,所以步骤⑦的目的是检验氧化铜化学性质是否改变(或能否再催化过氧化氢分解);
(8)过氧化氢在氧化铜的催化作用下生成氧气和水;
【第三组实验】
(9)从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差不变,说明装置不漏气;
(10)双氧水分解放热,生成的水会汽化,若不除去,会使测量值偏大,所以冰水的作用是除去氧气中的水蒸气;实验时气体收集在量气管中.若要保证读取的气体体积没有误差,在反应后读数前要上下移动水准瓶使两边液面相平;
(11)为减小误差,所选择的量气管应与生成气体的体积相近;
【拓展研究】(12)根据(11)中所测数据均为112.0mL,可得出结论:不同种类的催化剂不能改变生成氧气的量;
5mL 6%双氧水中含过氧化氢(H2O2)0.34g,则含有氧元素的质量为:
0.34g×
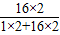 ×100%=0.32g
×100%=0.32g设生成氧气的质量为x
2H2O2
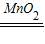 2H2O+O2↑
2H2O+O2↑68 32
0.34g x
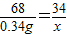
x=0.16g
∴过氧化氢中的氧元素并未全部转化为氧气.
故答案为:
【第一组实验】(1)使氧气中的水蒸气冷凝(除去氧气中的水蒸气)
(2)双氧水没有失效
【第二组实验】[猜想]Ⅲ.质量和化学性质不变
(3)完成下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 有气泡冒出 | 仍为0.2 g (氧化铜质量不变) | 使带火星木条复燃 |
(8)H2O2
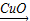 H2O+O2
H2O+O2【第三组实验】
(9)不变;
(10)使产生的氧气冷却到室温(或除去氧气中的水蒸气);移动水准瓶,使两边水面相平;
(11)B;
【拓展研究】
(12)[实验结论]:不能
5mL 6%双氧水中含过氧化氢(H2O2)0.34g,则含有氧元素的质量为:
0.34g×
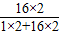 ×100%=0.32g
×100%=0.32g设生成氧气的质量为x
2H2O2
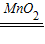 2H2O+O2↑
2H2O+O2↑68 32
0.34g x
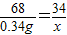
x=0.16g
∴过氧化氢中的氧元素并未全部转化为氧气.
点评:本题主要考查了催化剂能改变其他物质的反应速率,但本身的质量和化学性质在反应前后不变及过氧化氢分解的反应原理等相关知识;要证明某物质是某反应的催化剂,必须三方面都证明,才能说明该物质是该反应的催化剂,知识综合,有难度.

 阅读快车系列答案
阅读快车系列答案【第一组实验】检验该双氧水是否失效。
⑴ 实验过程
①在试管中加入5 mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
③如图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 。

⑵ 实验结论: 。
【第二组实验】探究:氧化铜(CuO)能否催化“双氧水”分解
[猜想] Ⅰ. CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ. CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ. CuO是反应的催化剂,反应前后 。
[实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验:

⑶ 完成下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中 , 带火星的木条复燃。 | | 溶液中有气泡放出, 。 | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |
⑷ 步骤③结束后,用手接触试管底部,感觉烫手。说明“双氧水”分解的化学反应 (选填“放热”或“吸热”)。
⑸ 步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗(带滤纸)、烧杯、 。
⑹ 操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 _(填序号)。

⑺ 步骤⑦的目的
⑻ 过氧化氢能被CuO催化分解放出O2的反应表达式为 。
【第三组实验】探究:不同种类催化剂能否改变“双氧水”分解出氧气的量
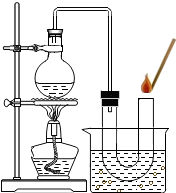
[实验]分别选用二氧化锰与氧化铜,采用如图试剂与装置实验,测量所得氧气的体积。

⑼ 检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。
⑽ 使用冷水冷凝的目的是 _。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数前,还需要进行的操作是 。
⑾ 两次实验表明,使用不同催化剂在常温下测得量气管读数均为112.0mL(O2的密度为1.43 g/L),则实验中选用的量气管规格合适的是 (填字母序号)。
A. 100 mL B.200 mL C. 500 mL
⑿ [实验结论]:不同种类的催化剂 改变双氧水分解出氧气的量。
【拓展研究】查阅资料得知实验所取5mL 6%双氧水中含过氧化氢(H2O2)0.34 g。请计算说明过氧化氢中的氧元素是否全部转化为氧气。(请写出计算过程,4分)
小明将家中清洗伤口用的消毒液——“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验。
【第一组实验】检验该双氧水是否失效。
⑴ 实验过程
①在试管中加入5 mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
③如右图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 。
⑵ 实验结论: 。
【第二组实验】探究:氧化铜(CuO)能否催化“双氧水”分解
[猜想] Ⅰ. CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ. CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ. CuO是反应的催化剂,反应前后 。
[实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验:
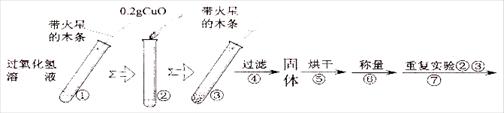
⑶ 完成下表:
|
步骤③现象 |
步骤⑥结果 |
步骤⑦现象 |
结论 |
|
溶液中 , 带火星的木条复燃。 |
|
溶液中有气泡放出, 。 |
猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |
⑷ 步骤③结束后,用手接触试管底部,感觉烫手。说明“双氧水”分解的化学反应 (选填“放热”或“吸热”)。
⑸ 步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗(带滤纸)、烧杯、 。
⑹ 操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 _(填序号).
⑺ 步骤⑦的目的
⑻ 过氧化氢能被CuO催化分解放出O2的反应表达式为 。
【第三组实验】探究:不同种类催化剂能否改变“双氧水”分解出氧气的量
[实验]分别选用二氧化锰与氧化铜,采用下图试剂与装置实验,测量所得氧气的体积
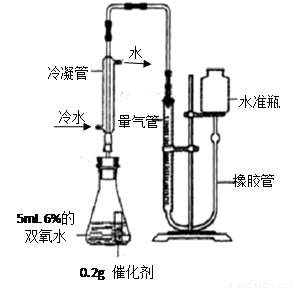
⑼ 检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。
⑽ 使用冷水冷凝的目的是 _。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数前,还需要进行的操作是 。
⑾ 两次实验表明,使用不同催化剂在常温下测得量气管读数均为112.0mL(O2的密度为1.43 g/L),则实验中选用的量气管规格合适的是 (填字母序号)。
A. 100 mL B.200 mL C. 500 mL
⑿ [实验结论]:不同种类的催化剂 改变双氧水分解出氧气的量。
【拓展研究】查阅资料得知实验所取5mL 6%双氧水中含过氧化氢(H2O2)0.34 g。请计算说明过氧化氢中的氧元素是否全部转化为氧气。(请写出计算过程,4分)
【第一组实验】检验该双氧水是否失效.
(1)实验过程
①在试管中加入5mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
③如图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是______.
(2)实验结论:______.
【第二组实验探究】:氧化铜(CuO)能否催化“双氧水”分解
[猜想]Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是反应的催化剂,反应前后______.
[实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验:
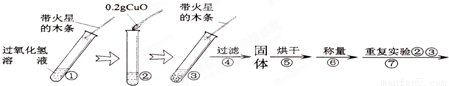
(3)完成下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中______, 带火星的木条复燃. | ______ | 溶液中有气泡放出, ______. | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立. |
(5)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗(带滤纸)、烧杯、______.
(6)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号).

(7)步骤⑦的目的______
(8)过氧化氢能被CuO催化分解放出O2的反应表达式为______
 小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验.
小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验.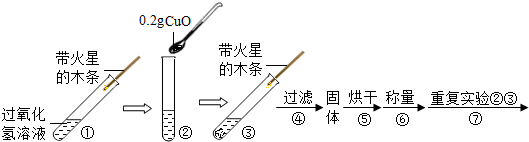
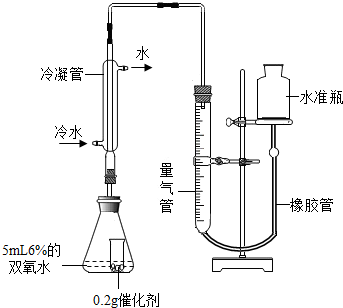 (9)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差
(9)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差