题目内容
【题目】乙醇的分子结构模型如图所示,则下列叙述不正确的是
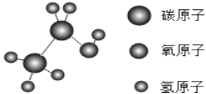
A.乙醇的化学式为C2H5OH B.一个乙醇分子中含有9个原子
C.乙醇中氧元素的质量分数最大 D.乙醇中碳、氧元素的质量比为3:2
【答案】C
【解析】
试题分析:A.由乙醇的分子结构模型,每个乙醇的分子由2个C原子、6个H原子和1个O原子所构成,乙醇的化学式可表示为C2H5OH,故A选项正确;
B.每个乙醇的分子由2个碳原子、6个氢原子和1个氧原子所构成,则每个乙醇分子中含有2+6+1=9个原子,故B选项正确;
C.乙醇中C、H、O元素的质量比是(12×2):6:16=12:3:8,可见其中碳元素的质量分数最大,故错误;
D.乙醇中碳、氧元素的质量比=(12×2):16=3:2,故正确。

【题目】(11分)某校化学兴趣小组将用剩的过氧化氢溶液倒入放有生锈铁钉的废液缸中,发现产生了大量的气泡,经检验此气体为氧气。根据学过的知识初步判断,是生锈铁钉中的某种物质加快了过氧化氢的分解,那么究竟是哪种物质加快了过氧化氢的分解速率?请你参与他们的研究,分享和体验探究实验的快乐。
【猜想与假设】
甲同学:铁钉表面的氧化铁加快了H2O2的溶液分解。
乙同学:铁钉里的 加快了H2O2的溶液分解。
【设计方案和实验】完成下列表格
实验方案 | 实验现象 | 结论 |
方案一:向盛有10mL 5% H2O2溶液的试管中加入2g 氧化铁粉末,将一根带火星的木条放在试管口,观察现象。 | 甲同学结论成立。 | |
方案二:向盛有10mL 5% H2O2溶液的试管中加入 粉末,将一根带火星的木条放在试管口,观察现象。 | 无现象 | 乙同学结论 。 (填“成立”或“不成立”) |
【讨论交流】丙同学认为“方案一”只能说明Fe2O3加快了H2O2溶液的分解,并不能说Fe2O3就一定是催化剂。你是否支持丙同学的观点? ,如果要证明氧化铁是催化剂,就要设计一个实验来证明,这个实验的设计原理是 。
【拓展】
(1)实验证明Fe2O3粉末可以作为H2O2分解的催化剂。该反应的文字表达式
(2)下表是丙同学探究影响H2O2分解速率时所记录的部分数据,通过对数据分析,你能得出什么结论? 。
用足量等体积H2O2溶液制取相同体积O2所需的时间:



