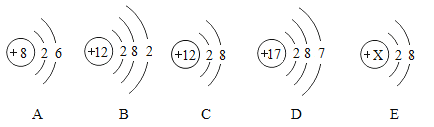
题目内容
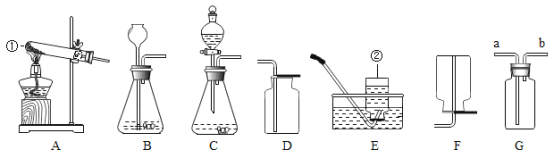
【题目】如图是实验室制取气体的部分装置,请根据实验装置回答问题。
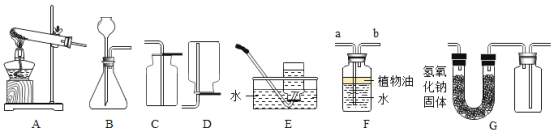
(1)在A一E中,实验室既可以制取二氧化碳,又可以制取氧气的发生和收集装置组合为_____。用该装置制取氧气的化学方程式为_____;
(2)若用装置E收集氧气,待观察到_____时开始收集。当观察到_____时,说明氧气已经集满;
(3)已知NH3是一种无色有刺激性气味的气体,密度比空气小,极易溶于水,实验室若用F装置收集NH3,则气体应从_____(填“a”或“b”)管进入。油层的作用是_____;
(4)若用G装置收集一瓶干燥的某气体,则该气体可以是_____(填序号)。
A 二氧化碳 B 氢气 C 氧气 D 二氧化硫
【答案】BC 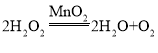 导管口气泡连续均匀冒出 集气瓶口有气泡冒出 b 防止氨气溶于水 B
导管口气泡连续均匀冒出 集气瓶口有气泡冒出 b 防止氨气溶于水 B
【解析】
(1)实验室常用 过氧化氢制取氧气、常用大理石(或石灰石)和稀盐酸反应制取二氧化碳,二者都属于固、液常温型,都可用装置B作发生装置;氧气和二氧化碳的密度都比空气大,都可用排水法收集,所以实验室既可以制取二氧化碳,又可以制取氧气的发生和收集装置组合为BC;过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)若用装置E收集氧气,待观察到导管中气泡均匀冒出时开始收集;当观察到集气瓶口有大气泡往外冒出时,说明氧气已经集满;
(3)已知NH3是一种无色有刺激性气味的气体,密度比空气小,极易溶于水,实验室若用F装置收集NH3,则气体应从b管进入;油层的作用是:防止氨气溶于水;
(4)根据装置G可以看出,能收集的气体不能和氢氧化钠固体反应,密度比空气小,故选:B。
故答案为:
(1)BC;2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)导管中气泡均匀冒出;集气瓶口有大气泡往外冒出;
(3)b;防止氨气溶于水;
(4)B。

 阅读快车系列答案
阅读快车系列答案【题目】某学习小组在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液,(如图所示),经实验员分析可知原瓶溶液中的溶质可能是 NaHCO3,NaOH,Na2CO3,NaCl中的一种,请你对该试剂作出猜想并进行实验探究:
(提出问题)这瓶试剂是什么溶液?
(猜想与假设)
甲猜想:NaHCO3溶液
乙猜想:NaOH溶液
丙猜想:Na2CO3溶液
丁猜想:NaCl溶液
(查阅资料)上述四种物质相关信息如下
物质 | NaHCO3 | NaOH | Na2CO3 | NaCl |
常温下溶解度/g | 9.6 | 109 | 21.5 | 36 |
常温下稀溶液的pH | 9 | 13 | 11 | 7 |
(实验探究1)取瓶中溶液少许于试管中,滴加几滴酚酞溶液,溶液变红。
(实验探究2)另取瓶中溶液少许于试管中,滴加足量的稀盐酸,产生生气泡。
(实验分析)通过(实验探究1)可知_____同学的猜想一定错误。
甲同学仔细分析四种物质的相关信息表后发现自已的猜想错误,他的理由是_____。
丙同学分析(实验探究2)并结合以上同学的实验结论,认为原瓶溶液是NaCO3溶液。
(实验探究2)中发生反应的化学方程式为_____。
(讨论质疑)乙认为以上同学分析有漏洞,需要进一步实验确定,于是又进行了如下探究。
(实验探究3)在(实验探究1)试管中的红色溶液中滴加过量氯化钙溶液(中性),充分反应后,试管中溶液仍呈红色,但有白色沉淀产生。
(得出结论)通过(实验探究3)可证明这瓶试剂为_____溶液,但已经部分变质。
(反思与拓展)学习小组反思了这瓶试剂因为_____而变质,得出了该溶液正确的保存方法,若要除去该溶液变质部分所采用的方法是_____(用化学反应方程式表示)。

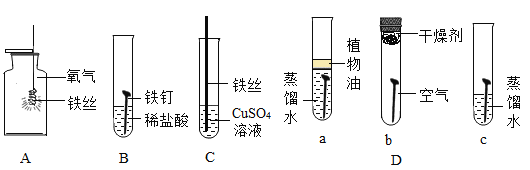
【题目】如图是实验室制取气体的常用装置,请回答有关问题:
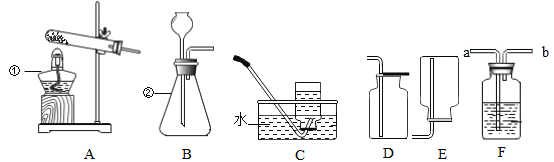
(1)写出图中标号仪器的名称:①_________,②_________。
(2)根据所给装置制取并收集不同的气体,完成下列表格:
气体 | 药品选择 | 反应原理 | 发生装置 | 收集装置 |
O2 | 氯酸钾和二氧化锰 | ________ | A | C或D |
CO2 | 大理石和______ |
| _______ | D |
H2 | 锌与稀硫酸 |
| B | C或_____ |
(3)若用68g未知浓度的过氧化氢溶液与2g二氧化锰制取氧气,完全反应后,称得剩余物质的质量为68.4g,则制得氧气的质量为_____g,该过氧化氢溶液中溶质的质量分数为______。
(4)用D装置收集二氧化碳;检验二氧化碳是否集满的操作是_______。
(5)若用F装置来干燥氢气,则装置中的试剂为________(填名称)。
【题目】化学是研究物质组成、结构、性质以及变化规律的学科。某实验小组同学在老师的指导下开展了一系列探究物质组成的实验活动。
活动与探究一:探究不同物质的组成元素
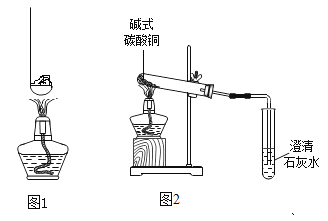
(1)如图1,取少量葡萄糖、白砂糖、面粉分别放在燃烧匙中,在酒精灯上加热,直至完全烧焦,燃烧匙中所剩物质均呈黑色,由此可知葡萄糖、白砂糖、面粉中都含有________________________元素。
(2)如图2,加热碱式碳酸铜的实验过程中,观察到什么现象时也可说明碱式碳酸铜中含有与葡萄糖、白砂糖、面粉相同的某种元素?________________________。
活动与探究二:探究葡萄糖的元素组成
[设计方案]如图3 所示:
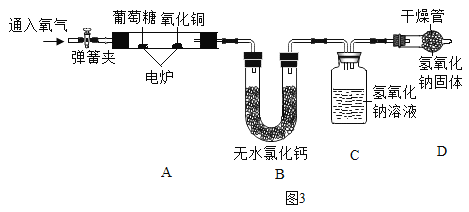
[分析讨论](1)实验前要先通一会儿氧气,目的是________________________。
(2)C中发生反应的化学方程式为________________________。
(3)装置D的作用是________________________。
(4)装置B、C________________________(填“能”或“不能”)互调,请说明原因________________________。
[数据处理及误差分析]
1.8g葡萄糖完全燃烧后装置B、C在反应前后的质量变化如下表所示(假设各装置均能充分吸收有关气体):
装置 | B | C |
质量变化 | 增加了1.08 g | 增加了2.64 g |
(1)由以上数据分析可知,葡萄糖是由______________种元素组成的,写出计算过程证明你的结论______________。
(2)若A装置中没有氧化铜,可能会导致计算出的碳元素质量________________________(填“偏大”、“不变”或“偏小”)。
[评价与反思]为了尽量减少误差,该实验在进行过程中应注意的问题是________________________。(写一点)