��Ŀ����
����Ŀ������ͼ�����о���ѧ�����һ�ֳ���������������������ͼ����лش�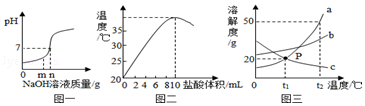
��1��ͼһ����������������ƽ����кͷ�Ӧʱ����Ӧ��������Һ��pH�仯���ߣ��������м��������������Һ����Ϊmgʱ��������Һ�к��е�����Ϊ�������ӷ��ţ���
��2��ͼ����20��ʱ��ȡ10mL10%��NaOH��Һ���ձ��У���μ���10%�����ᣬ��������ļ��룬�ձ�����Һ�¶��������������ı仯��ϵ��
����ͼ��֪�кͷ�Ӧ�Ƿ��ȷ�Ӧ���������Ϊ��
�ڼ�ͬѧ���������ƹ�����ϡ���ᷴӦҲ�ܵõ���ͬ���ۣ���ͬѧ��Ϊ�����ܣ���Ϊ��
��3��ͼ����a��b��c�������ʵ��ܽ�����ߣ�a��c���ܽ���ཻ��P�㣬��ͼ�ش�
��t1��ʱ���ӽ����͵�c������Һ���ڲ��ı���Һ�����������£������ķ����ﵽ����״̬��
�ڽ�t2��ʱ��150ga���ʵı�����Һ���µ�t1��ʱ����������ga���ʣ�
���𰸡�
��1��Na+��Cl����H+
��2����ʼ���ŷ�Ӧ�Ľ��У���Һ�¶������ߣ��������ƹ�������ˮ����
��3�����£�30
���������⣺��1���������м��������������Һ����Ϊmgʱ��������Һ�к��е�����Ϊ��Ӧ���ɵ��Ȼ����е������Ӻ������Ӽ��������ϡ�����е������Ӻ������ӣ����Na+��Cl����H+ �� ��2������ͼ��֪�кͷ�Ӧ�Ƿ��ȷ�Ӧ�������ǿ�ʼ���ŷ�Ӧ�Ľ��У���Һ�¶������ߣ������ʼ���ŷ�Ӧ�Ľ��У���Һ�¶������ߣ������������ƹ�����ϡ���ᷴӦ���ܵõ���ͬ���ۣ�������Ϊ�������ƹ�������ˮ���ȣ����ж���Һ�¶���������������ԭ���µģ�����������ƹ�������ˮ���ȣ���3����t1��ʱ���ӽ����͵�c������Һ���ڲ��ı���Һ�����������£�����c���ܽ�������¶����߶���С����˿������µķ����ﵽ����״̬��������£��ڽ�t2��ʱ��a���ܽ����50g��150ga���ʵı�����Һ������������50g�����µ�t1��ʱa���ܽ����20g����˿�������30ga���ʣ����30��
�����㾫����������Ŀ����֪���������ù����ܽ�����������ú��кͷ�Ӧ����Ӧ�õ����֪ʶ���Եõ�����Ĵ𰸣���Ҫ����1������ָ���¶�ʱ���ʵ��ܽ�ȣ��������ܽ���ж��ܽ��ԣ�2���Ƚ���ͬ�¶�ʱ����һ���¶ȷ�Χ�ڣ���ͬ�����ܽ�ȵĴ�С��3���ȽϺ�ȷ�����ʵ��ܽ�����¶�Ӱ��ij̶ȣ����ݴ�ȷ�����ʽᾧ����������ᴿ�ķ�����4��ȷ����Һ��״̬�������벻���ͣ����кͷ�Ӧ����������������κ�ˮ�ķ�Ӧ��