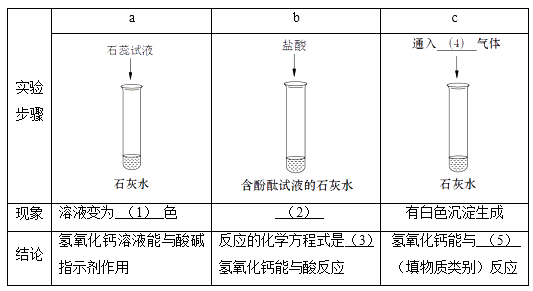
题目内容
【题目】锌粒投入硫酸铜溶液中,观察到的现象是_________除此之外,细心的同学还看到有一种无色无味气体产生。为确定气体的成分,进行下列实验探究。
【猜想与假设】:依据_______可知气体可能是SO2、O2、H2中的一种或几种。
【查阅资料】:
①SO2能使酸性高锰酸钾溶液褪色。
②O2+4KI+4HCI==2I2+4HCI+2H2O,淀粉遇I2变蓝。
③H2、CO等气体能将氧化铜还原成铜。
【实验验证】:
(1)将气体通入酸性高锰酸钾溶液中,无现象,则该气体中无SO2能。小明同学认为没有必要做这个实验就可以确定无SO2生成,他的依据是_________________.
(2)用下列所示实验检验氢气和氧气(浓硫酸主要用于干燥气体):
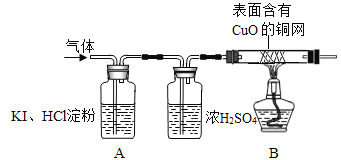
A中观察到________,证明无O2:B中观察到_________,证明该气体是H2.
【实验反思】:大家认为在加热之前,应对气体先_________以确保安全。
【答案】 锌粒表面有红色固体析出,溶液由蓝色逐渐变为无色 质量守恒定律 SO2具有刺激性气味,而实验中产生的是一种无色无味的气体 溶液颜色没有变化 黑色的粉末逐渐变为红色 验纯
【解析】锌粒投入硫酸铜溶液中,锌和硫酸铜反应生成铜和硫酸亚铁,观察到的现象是:锌粒表面有红色固体析出,溶液由蓝色逐渐变为无色;猜想与假设:依据①质量守恒定律可知气体可能是SO2、O2、H2中的一种或几种;实验验证:(1) (1)将气体通入酸性高锰酸钾溶液中,无现象,则该气体中无SO2能。小明同学认为没有必要做这个实验就可以确定无SO2生成,他的依据是SO2具有刺激性气味,而实验中产生的是一种无色无味的气体;(2)A中观察到无明显现象,证明无O2;B中观察到黑色固体逐渐变红,且管壁有水珠,证明该气体是H2;实验反思:因为氢气是可燃性气体,如果不纯,加热时会发生爆炸,故大家认为在加热之前,应对气体先验纯以确保安全。

【题目】小明在室温20℃时探究硝酸钾溶于水的情况。已知硝酸钾在不同温度下的溶解度如表所示:
温度/℃ | 10 | 20 | 60 | 100 |
溶解度/g | 20.9 | 31.6 | 110 | 246 |
A烧杯盛有20mL水,他进行了如下实验: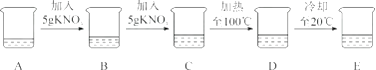
整个过程溶剂的量不变,根据有关资料回答问题:
(1)A→B、B→C操作中均需用到(填仪器名称);
(2)上述实验过程中属于饱和溶液的是(填字母,下同);
(3)在B,C,D,E中,溶液的溶质质量分数最小是;
(4)现在需要配制溶质质量分数为60%的硝酸钾饱和溶液,温度必须。