题目内容
【题目】某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算: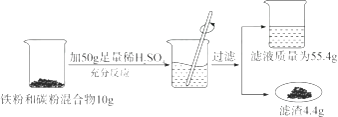
(1)混合物中铁的质量为;
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数;(写出计算过程)
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水g。
【答案】
(1)5.6g
(2)19.6%
(3)160
【解析】(1)混合物中铁的质量为10g-4.4g=5.6g;
(2)生成氢气的质量为50g+10g-55.4g-4.4g=0.2g,设稀硫酸中溶质的质量为x,
Fe+H2SO4=FeSO4+H2↑
98 2
x 0.2g![]() =
=![]()
x=9.8g
所用稀硫酸溶液中溶质的质量分数为![]() ×100%=19.6%;
×100%=19.6%;
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,设需要水的质量为y,
(200g-y)×98%=200g×19.6%,y=160g.
故答案为:(1)5.6g;(2)19.6%;(3)160.
(1)由于混合物中只有碳不和硫酸反应,用混合物的质量减去滤渣的质量即为铁的质量;
(2)写出铁和硫酸反应的化学反应方程式,然后根据氢气的质量求出硫酸溶液中溶质的质量,最后根据溶质的质量分数等于溶质的质量除以溶液的质量再乘以100%进行解答即可;
(3)根据稀释前后溶质的质量不变解答即可.

练习册系列答案
相关题目
【题目】一些食物的近似PH值如下:
食物 | 葡萄汁 | 苹果汁 | 牛奶 | 鸡蛋清 |
pH | 3.5-4.5 | 2.9-3.3 | 6.3-6.6 | 7.6-8.0 |
下列说法中不正确的是
A.鸡蛋清显碱性
B.葡萄汁比苹果汁酸性强
C.胃酸过多的人应少饮葡萄汁和苹果汁
D.苹果汁、葡萄汁、牛奶都显酸性