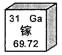
题目内容
【题目】取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为8.0 g,剩余固体中钙元素质量分数为50.0%。 (已知CaCO3![]() CaO+CO2↑)下列判断正确的是
CaO+CO2↑)下列判断正确的是
A. 生成2.2 g CO2气体
B. 将生成的气体通入到澄清石灰水中可产生5g沉淀
C. 原来CaCO3的质量为10g
D. 将剩余固体加入到足量的稀盐酸中又可产生2.2g气体
【答案】C
【解析】
根据碳酸钙分解的化学方程式CaCO3![]() CaO+CO2↑,结合质量守恒定律可知,在反应前后钙元素的质量相等,所以反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,可以据此结合化学方程式进行解答。
CaO+CO2↑,结合质量守恒定律可知,在反应前后钙元素的质量相等,所以反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,可以据此结合化学方程式进行解答。
A、根据质量守恒定律可知,生成二氧化碳的质量=10.0g-8.0g=2.0g,故A错误;
B、设将生成的气体通入到澄清石灰水中可产生沉淀的质量为x,
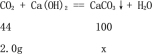
![]() x<5g,选项错误;
x<5g,选项错误;
C、所以反应前碳酸钙的质量=4.0g÷![]() ×100%=10.0g,故C正确;
×100%=10.0g,故C正确;
D、设生成氧化钙的质量为x,消耗碳酸钙的质量为y
CaCO3![]() CaO + CO2↑
CaO + CO2↑
100 5644
y x2.0g
![]()
解得,x=2.55g,y=4.55g
则剩余的碳酸钙的质量=10.0g-4.55g=5.45g,设5.45g碳酸钙和盐酸反应生成二氧化碳的质量为m
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
5.45g m
![]() m>2.2g 故D选项错误。故选C。
m>2.2g 故D选项错误。故选C。

 阅读快车系列答案
阅读快车系列答案【题目】“舌尖上的中国”热播以来,让众多吃货为之疯狂。厨房里的大师们在炒菜时,加料酒后又加醋,就让菜肴变得香美可口,这其实隐藏了一个化学的小秘密:醋中的乙酸与料酒中的乙醇反应生成有香味的乙酸乙酯。下表中是几种常见的酯,请完成下列问题:
酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 |
化学式 | C2H4O2 | C3H6O2 | C3H6O2 | X |
(1)甲酸甲酯(C2H4O2)中碳元素、氢元素、氧元素的质量比为_______;其中碳元素的质量分数为_______;
(2)比较归纳是学习化学的重要方法,据表推测X的化学式为_______;
(3)若菜肴中的乙酸乙酯在体内代谢时,其所含的碳元素完全转化为CO2,则44mg的乙酸乙酯完全代谢产生的CO2的质量为多少_______?(请写出计算过程)