题目内容
现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3 + HCl = NaHCO3 + NaCl,然后才发生反应:NaHCO3+ HCl = NaCl + CO2↑+ H2O。
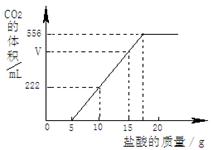
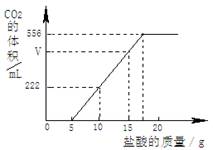
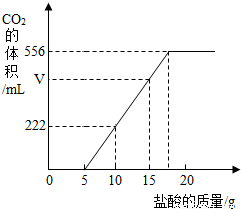
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如右图。
(1)当加入 g盐酸时,才开始产生CO2;图中V= mL。
(2)请计算:①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?
(百分数精确到0.1%,质量精确到0.01g)
 |
![]() (1)0 444
(1)0 444
(2)解:① 44.4 mLCO2的质量为:
设产生0.88gCO2时,消耗HCl的质量为x g
NaHCO3+ HCl = NaCl +CO2↑+ H2O
36.5 44
![]() x 0.88g
x 0.88g
解得:x = 0.73g
0.73÷(15-5)×100% = 7.3%(方法有多种,合理均给分)
②设加入5g盐酸时,有yg Na2CO3转化为zgNaHCO3。
Na2CO3 + HCl ===== NaHCO3 + NaCl
106 36.5 84
y 5g×7.3% z
![]()
![]()
解得: y =1.06g. z =0.84g.
556mLCO2的质量为:[556mL ÷(1000mL)] ×1.98g/L=1.10g
设放出556mLCO2时反应的NaHCO3质量为m。则:
NaHCO3+ HCl = NaCl +CO2↑+ H2O
![]() 84 44
84 44
m 1.10g 解得:m = 2.10g
则原样品中NaHCO3的质量为:2.1g-0.84g= 1.26g
答:①盐酸中HCl的质量分数为7.3%;②原样品中有Na2CO31.06g.、NaHCO3 1.26g。

 计算高手系列答案
计算高手系列答案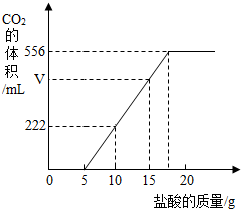 现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.
现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.