题目内容
现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3 + HCl = NaHCO3 + NaCl,然后才发生反应:NaHCO3+ HCl =" NaCl" + CO2↑+ H2O。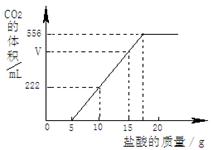
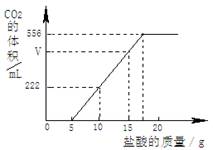
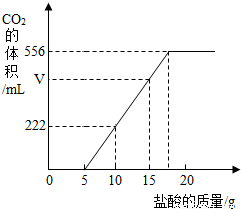
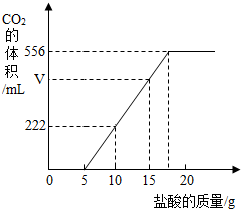
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如右图。
(1)当加入 g盐酸时,才开始产生CO2;图中V= mL。
(2)请计算:①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?(百分数精确到0.1%,质量精确到0.01g)
(1)5 444 (2)①7.3% ②原样品中有Na2CO31.06g,NaHCO31.26g
解析试题分析:(1)从图象可以看出,加入5克盐酸后,才开始有二氧化碳气体出现;从图象可以看出,加入(10-5)克盐酸,放出二氧化碳的体积是222毫升;所以,加入(15-5)克盐酸时,放出二氧化碳气体的体积V =222毫升×2═444毫升。
(2)由题意可知,盐酸是先后和Na2CO3、NaHCO3反应的,而只有后者才产生二氧化碳,结合图像,找出生成的二氧化碳的体积并换算出质量,利用化学方程式可计算出相应盐酸的质量,从而求出盐酸的溶质质量分数。
解:①444mLCO2的质量=444mL×10-3×1.98g/L=0.88g;
设产生0.88gCO2时,消耗HCl的质量为x
NaHCO3 + HCl =" NaCl" + H2O +CO2↑
36.5 44
x 0.88g
36.5:44= x:0.88g
解得x = 0.73g
所以盐酸中HCl的质量分数= ×100% = 7.3%
×100% = 7.3%
结合图像,根据盐酸的质量,可求出与之反应的Na2CO3的质量,以及反应生成的NaHCO3的质量;再由NaHCO3与盐酸的反应方程式,利用生成的二氧化碳的质量可求出反应的NaHCO3的质量,后者与前者的质量差,即为原样品中NaHCO3的质量。
②设原样品中Na2CO3质量为y,与5g盐酸反应时,生成碳酸氢钠的质量为z
Na2CO3 + HCl = NaHCO3 + NaCl
106 36.5 84
y 5g×7.3% z
106:36.5= y:5g×7.3%
36.5:84= 5g×7.3%:z
解得:y = 1.06g
z=0.84g
556mLCO2的质量为:(556mL/1000mL)×1.98g/L=1.10g
设放出556mLCO2时,反应的NaHCO3质量为m。则:
NaHCO3 + HCl =" NaCl" + H2O +CO2↑
84 44
m 1.10g
84 :44= m:1.10g
解得m=2.10g
则原样品中NaHCO3的质量为2.10g-0.84g=1.26g
答:①盐酸中HCl的质量分数为7.3%;②原样品中有Na2CO31.06g,NaHCO31.26g。
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:此题是关于化学方程式及溶质质量分数的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力;解题的关键是找出相关的化学反应,以及通过观察、分析和比较图表中的多组数据,找出有用数据,结合方程式中已知量对未知的应求量的质量比进行求解计算,解题要规范。

 现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.
现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.