题目内容
测定溶解度有多种方法,下列是测定30℃时硫酸铜溶解度的实验方法。经查找资料,30℃时硫酸铜的溶解度为25g/100gH2O。
一、配置30℃时的硫酸铜饱和溶液:
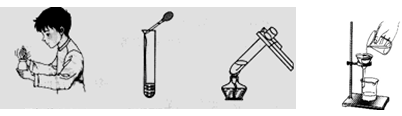
(1)配置的步骤如图:
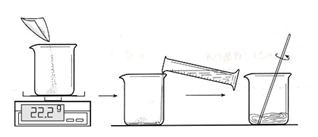
取用100mL水,图中称量得到22.2g硫酸铜用于实验,是否合理,请说出理由 ;并在30℃的水浴中加热硫酸铜溶液一段时间,保证硫酸铜完全溶解,得到饱和溶液。
二、测量一定质量饱和硫酸铜溶液中硫酸铜的质量:
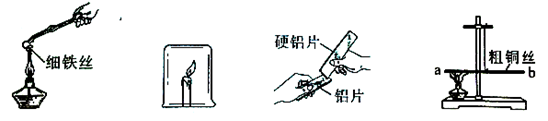
(2)在已配得的30℃时饱和溶液中,迅速取出饱和溶液50g,采用蒸发的方法求得硫酸铜的质量。从饱和溶液中析出蓝色晶体的化学式为(10) ,得到晶体后还要继续加热,直至固体颜色变为(11) 色为止。此操作过程中,用到的仪器除铁架台、酒精灯外,还需(12) 。
(3)最后称量得到固体质量为9.8g,经计算得到此时硫酸铜的溶解度为(13) g/100gH2O(精确到0.1g)。实验反思:实验数值比资料中的数据偏小,可能的原因是(14) (写出一条即可);
(4)测量50g饱和硫酸铜溶液中硫酸铜的质量,还可以使用重量法。
实验原理:CuSO4+BaCl2 →CuCl2+BaSO4↓
该实验方法中一定还要用到的实验操作是(15) (填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
一、配置30℃时的硫酸铜饱和溶液:
(1)配置的步骤如图:

取用100mL水,图中称量得到22.2g硫酸铜用于实验,是否合理,请说出理由 ;并在30℃的水浴中加热硫酸铜溶液一段时间,保证硫酸铜完全溶解,得到饱和溶液。
二、测量一定质量饱和硫酸铜溶液中硫酸铜的质量:
(2)在已配得的30℃时饱和溶液中,迅速取出饱和溶液50g,采用蒸发的方法求得硫酸铜的质量。从饱和溶液中析出蓝色晶体的化学式为(10) ,得到晶体后还要继续加热,直至固体颜色变为(11) 色为止。此操作过程中,用到的仪器除铁架台、酒精灯外,还需(12) 。
(3)最后称量得到固体质量为9.8g,经计算得到此时硫酸铜的溶解度为(13) g/100gH2O(精确到0.1g)。实验反思:实验数值比资料中的数据偏小,可能的原因是(14) (写出一条即可);
(4)测量50g饱和硫酸铜溶液中硫酸铜的质量,还可以使用重量法。
实验原理:CuSO4+BaCl2 →CuCl2+BaSO4↓
该实验方法中一定还要用到的实验操作是(15) (填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
(1)不合理,该溶液未达到饱和状态
(2)CuSO4·5H2O (11)白 (12)蒸发皿、玻璃棒
(3)24.5 加热固体时可能有部分固体飞溅出来(或:后续实验时可能溶液温度已经下降了)
(4)过滤 10.0g
(2)CuSO4·5H2O (11)白 (12)蒸发皿、玻璃棒
(3)24.5 加热固体时可能有部分固体飞溅出来(或:后续实验时可能溶液温度已经下降了)
(4)过滤 10.0g
试题分析:根据查阅的资料可知识,30℃时100mL水中溶解25g硫酸铜才能达到饱和,现在只有22g硫酸铜所以形不成饱和溶液;硫酸铜从水中析出时会带上5个分子的结晶水,所以其化学式是CuSO4·5H2O;带有结晶水的硫酸铜晶体是蓝色的,要得到硫酸铜粉末,还需要颜色变为白色;在溶液的蒸发操作中除用到除铁架台、酒精灯外,还需要蒸发皿、玻璃棒等仪器;30℃时50g硫酸铜饱和溶液中,含有9.8g硫酸铜,所以30℃时测得的硫酸铜的溶解度为
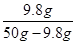 ×100g=24.5g;由于加热固体时可能有部分固体飞溅出来,所以实验数值比资料中的数据偏小;由于重量法需要称出反应生成的硫酸钡的质量,把难溶于水的固体硫酸钡从水中提取出来的方法是过滤,所以还要用到过滤操作;计算溶液中硫酸铜的质量需要根据生成硫酸钡的质量及硫酸铜与氯化钡反应的化学方程式进行计算即可。
×100g=24.5g;由于加热固体时可能有部分固体飞溅出来,所以实验数值比资料中的数据偏小;由于重量法需要称出反应生成的硫酸钡的质量,把难溶于水的固体硫酸钡从水中提取出来的方法是过滤,所以还要用到过滤操作;计算溶液中硫酸铜的质量需要根据生成硫酸钡的质量及硫酸铜与氯化钡反应的化学方程式进行计算即可。解:设生成硫酸铜质量为x
CuSO4+BaCl2 →CuCl2+BaSO4↓
160 233
x 9.8g
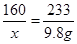
x=10.0g
答:生成硫酸铜10.0克

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目