题目内容
【题目】根据图文回答问题。

(1)硫酸钾属于_____(填“复合”或“钾”)肥。
(2)清蒸鱼富含_____(填“油脂”或“蛋白质”)。
(3)聚乙烯能制成薄膜,因为它具有_____(填“热塑”或“热固”)性。废弃塑料不回收会造成_____污染。
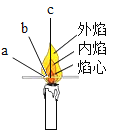
(4)烹调食物所用燃料天然气的主要成分是_____(填化学式),观察到火焰呈黄色或橙色时,需将灶具的空气进风口调_____(填“大”或“小”)。
(5)一定质量的某有机化合物完全燃烧,生成2.2gCO2和1.8gH2O,另取3.2g该有机化合物在O2中完全燃烧,消耗4.8gO2,该有机化合物的化学式可能是_____。
【答案】钾 蛋白质 热塑 白色 CH4 大 CH4O
【解析】
(1)硫酸钾只含钾元素,属于钾肥。故填:钾;
(2)清蒸鱼富含蛋白质。故填:蛋白质;
(3)聚乙烯能制成薄膜,因为它具有热塑性。废弃塑料不回收会造成白色污染。故填:热塑;白色;
(4)天然气的主要成分是甲烷,化学式为:CH4;燃气灶的火焰呈黄色,是由于燃气燃烧不充分造成的,此时可将灶具的进风口调大,以利于燃气充分燃烧;故填:CH4;大;
(5)因为“一定质量的某有机化合物完全燃烧,生成2.2gCO2和1.8gH2O,另取3.2g该有机化合物在O2中完全燃烧,消耗4.8gO2”,由质量守恒定律可知,3.2g该有机化合物在O2中完全燃烧,消耗4.8gO2,同时生成4.4gCO2和3.6gH2O,该有机物中含碳元素的质量为:4.4g×![]() ×100%=1.2g;含氢元素的质量为:3.6g×
×100%=1.2g;含氢元素的质量为:3.6g×![]() ×100%=0.4g;则其中含氧元素的质量为:3.2g﹣1.2g﹣0.4g=1.6g。则该有机物中,碳、氢、氧的原子个数比为:
×100%=0.4g;则其中含氧元素的质量为:3.2g﹣1.2g﹣0.4g=1.6g。则该有机物中,碳、氢、氧的原子个数比为:![]() :
:![]() :
:![]() =1:4:1。
=1:4:1。
故填:CH4O。

 灵星计算小达人系列答案
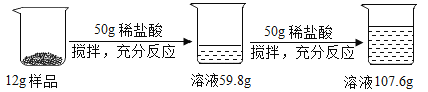
灵星计算小达人系列答案【题目】实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验。

①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克,
②向上述3个烧杯中分别加入3 份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据记录如下:
实验一 | 实验二 | 实验三 | |
反应前稀盐酸+烧杯质量(克) | 150 | 150 | 150 |
反应前固体样品质量(克) | 4 | 8 | 12 |
反应后烧杯内物质+烧杯质量(克) | m | 155.8 | 158.7 |
已知实验中发生的化学反应:NaOH+HCl=NaCl+H2O
Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑
(1)分析表中教据,写出判断实验二中的样品已完全反应的理由__________。
(2)表中的m 值为________。
(3)根据实验二的数据计算样品中Na2CO3的质量分数。
【题目】按要求回答下列各题。
(1)在下表空格中填写相应的化学式。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 |
KCl | CaCl2 | NaCl | _____ | AlCl3 | ZnCl2 | FeCl2 |
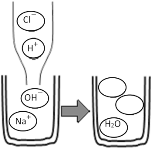
(2)如图表示稀盐酸和氢氧化钠溶液发生反应的微观过程,请你将如图空白圆圈中的离子符号填写到下面空格上_____、_______;请你说出盐酸与氢氧化钠反应的微观实质:____