题目内容
某兴趣小组对“水的化学式是如何以实验方法确定的”进行研究:(1)提出假设:设水的化学式为H2O
(2)查阅资料:在标准状况下,氢气的密度为0.089g/L,氧气的密度为1.429g/L,氢的相对原子质量为1,氧的相对原子质量为16。
(3)研究原理:运用化合物中各元素的质量比等于组成化合物各元素的实际质量之比的原理,求出一个水分子中氢原子和氧原子的个数比。
(4)实验探究:
|
实验操作 |
实验装置图 |
实验记录及结果 |
|
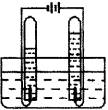
①用右图所示的装置电解水 ②检验生成的气体 |
|
①经检验,和负极相连的一端产生的气体是________。 ②和负极相连的一端产生的气体与和正极相连的一端产生的气体体积比约为________。 由此实验说明:水是由氢、氧两元素组成的。 |
(5)数据处理:兴趣小组首先设水的化学式为HxOy,再根据实验结果及有关数据,并利用研究原理进行了计算。请你将其计算过程进行补充(最后结果取整数)。
答案:
解析:
提示:
解析:
H2(或氢气);2:1;H2O
提示:
电解水时,负极产生的气体是氢气,正极产生的气体是氧气,它们的体积比是2:1;根据实验得到的氢气和氧气的体积以及它们的密度计算它们各自的质量,根据质量守恒定律,反应生成的氢气和氧气的质量比就等于水中氢元素和氧元素的质量比,进而求出一个水分子中氢原子和氧原子的个数比。

练习册系列答案
相关题目
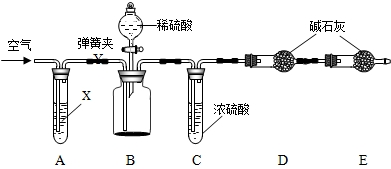
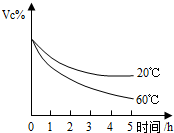 维生素C是一种人体必需的维生素,查阅资料可知下列信息:
维生素C是一种人体必需的维生素,查阅资料可知下列信息: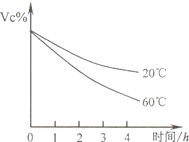 维生素C是一种人体必需的维生素.查阅资料可知下列信息:
维生素C是一种人体必需的维生素.查阅资料可知下列信息: