题目内容
【题目】某合金主要成分为 Zn、Fe、Cu 及这三种金属的少量氧化物。实验室利用该合金制成的机械零件废弃物制取高纯度氧化锌,其部分工艺如图所示,请回答:已知:Zn(OH)2溶于强碱行成可溶性盐。
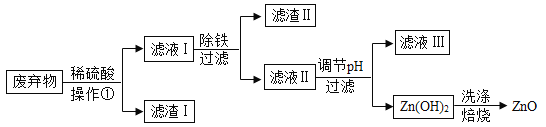
(1)操作①中用到的玻璃仪器有烧杯、玻璃棒和 ______________________;滤渣 I 中一定有___________________(写化学式)。
(2)加稀硫酸溶解废弃物时,需要通风并远离火源,原因是___________________;此过程中Zn 还能起到除铜作用,除铜的化学方程式为___________________,此反应属___________________(填基本反应类型)。
(3)调节pH 可用 NaOH,但不能过量,其原因是___________________。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为___________________。
【答案】漏斗 Cu 生成的H2 具有可燃性 Zn CuSO4 = Cu+ZnSO4 置换反应 氢氧化锌会溶于强碱,导致产率降低 Zn (OH)2![]() ZnO + H2O
ZnO + H2O
【解析】
废弃物含有Zn、Fu、Cu 及这三种金属的少量氧化物,加入稀硫酸,不能和铜反应,和锌反应生成硫酸锌和氢气,和铁反应生成硫酸亚铁和氢气,和锌、铁、铜的氧化物反应生成盐和水,滤液I除铁后所得到的滤液II中主要含有锌离子,调pH生成Zn (OH)2,再发生分解反应生成ZnO。
(1)操作①中用到的玻璃仪器有烧杯、玻璃棒和漏斗;滤渣Ⅰ中一定有Cu,故答案为:漏斗;Cu。
(2)加稀硫酸溶解废弃物时,需要通风并远离火源,原因是反应生成H2,H2具有可燃性,远离火源以免发生爆炸,
此过程中Zn还能起到除铜作用,除铜的化学方程式为:Zn+CuSO4═ZnSO4+Cu,是置换反应;故答案为:生成的H2具有可燃性;Zn+CuSO4═ZnSO4+Cu;置换反应;
(3)调节pH可用NaOH,但不能过量,其原因是氢氧化锌能和氢氧化钠反应;故填:氢氧化锌会溶于强碱,导致产率降低;
(4)焙烧Zn(OH)2发生分解反应的化学方程式为:Zn (OH)2![]() ZnO + H2O,故答案为:Zn (OH)2
ZnO + H2O,故答案为:Zn (OH)2![]() ZnO + H2O。
ZnO + H2O。

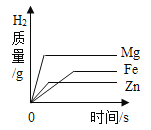
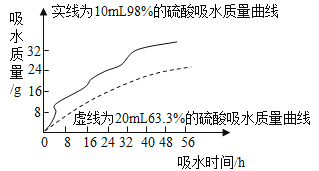
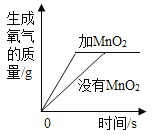
【题目】利用曲线图对化学实验中的数据进行分析可以帮助我们对研究对象形成规律化的认识,下列各选项中观察曲线图后得到的结论正确的是
|
|
A.等质量的金属与足量的稀硫酸反应:活动性越强的金属生成的氢气就越多 | B.两种溶质质量分数的硫酸吸水性强弱的比较:质量分数越大的硫酸吸收水的质量越多 |
|
|
C.某物质不同温度下的溶解度:此物质的溶解度随温度升高而减小 | D.二氧化锰对过氧化氢制氧气的影响:加入二氧化锰使H2O2生成氧气的量增多了 |
A.AB.BC.CD.D