题目内容
【题目】将一定质量的镁粉加入到某AgNO3与Cu(NO3)2的混合溶液中,充分反应后过滤,再分别向 滤渣和滤液中加入稀盐酸,均无明显现象。结合实际现象判断,下列结论错误的是( )
A.滤液中一定没有银离子B.滤渣中一定含有铜单质
C.滤液可能是蓝色溶液D.滤渣质量一定大于所加镁粉的质量
【答案】B
【解析】
金属活动性顺序可知,四种金属的活动性顺序为:镁>铜>银,向AgNO3和Cu(NO3)2的混合溶液中加入一定质量的镁粉,镁会先与硝酸银反应,硝酸银反应结束,然后再与硝酸铜反应,充分反应后过滤,分别向滤渣和滤液中加入稀盐酸,均无明显现象,所以溶液中一定不含硝酸银,滤渣中一定不含镁。
A、滤液中一定没有银离子,正确;
B、通过推导可知,滤渣中一定含有银,可能含有铜,错误;
C、加入的镁可能没有将硝酸铜完全反应,滤液为蓝色,正确;
D、镁与硝酸银反应生成硝酸镁和银,化学方程式为:![]() ,由化学方程式可知,生成银的质量大于参加反应镁的质量,所以滤渣质量一定大于所加镁粉的质量,正确。
,由化学方程式可知,生成银的质量大于参加反应镁的质量,所以滤渣质量一定大于所加镁粉的质量,正确。
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】某国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表:(假设纸张其他成分既不溶于水,也不与水反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成 气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
(1)表中X的值为;______
(2)求样品中碳酸钙的质量分数;_____
(3)计算所用稀盐酸溶质的质量分数?_______
【题目】请根据下列各图中提供的信息回答问题。
I.实验室制备并收集二氧化碳。
选用药品。按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应),产生二氧化碳体积随时间变化曲线如图所示。(提示:硫酸钙微溶于水)
实验编号 | 药品 |
Ⅰ | 块状大理石、10% H2SO4溶液 |
Ⅱ | 块状大理石、7% HCl溶液 |
Ⅲ | 大理石粉末、7% HCl溶液 |
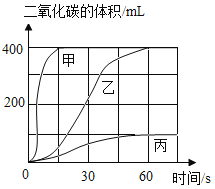
图中丙对应实验________(选填“Ⅰ”、“Ⅱ”或“Ⅲ”)确定用乙对应的药品制备并收集二氧化碳,反应的化学方程式是_____________________。
Ⅱ.利用以下实验装置进行实验,请回答下列问题。
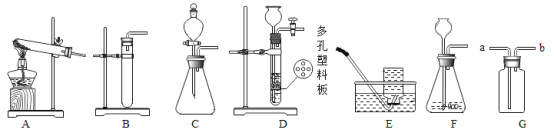
(1)加热高锰酸钾制取并收集较为纯净的氧气,选用的装置是_________(填写字母)。写出反应的化学方程式_______________________。
(2)装置D、F都可用来制取二氧化碳,装置D相对于装置F的优势是______________。若用G装置收集二氧化碳,气体应从____________(填a或b)端进入。