题目内容
【题目】实验室有一瓶久置的氢氧化钠固体,某兴趣小组同学想了解其变质情况,甲、乙同学各称取9.3g干燥的样品分别设计以下实验,实验过程如下:
(1)实验一:甲同学取样品,加水使其完全溶解,然后向其中逐渐滴加氢氧化钙溶液,所得沉淀质量与加入氢氧化钙溶液质量关系如图所示,请回答以下问题:
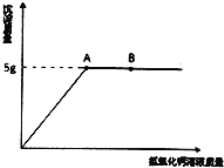
①B点对应的溶液中的溶质有__.
②实验中若用氯化钙溶液代替氢氧化钙溶液,所得沉淀的质量__5g(填“大于”“等于”“小于”)
(2)计算样品中碳酸钠的质量__,通过计算可知该氢氧化钠固体的变质程度为__.(填“完全变质”“部分变质”“没有变质”)
(3)实验二,乙同学取样品,加水使其完全溶解,往其中加入质量分数为7.3%的盐酸溶液,滴加至100克时,不再产生气体,请画出生成气体随加入盐酸溶液质量变化的曲线图:_____。
【答案】 NaOH Ca(OH)2 等于 5.3g 部分变质 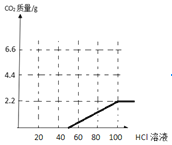
【解析】(1)①B点对应的溶液是氢氧化钙和碳酸钠反应后氢氧化钙过量的点,因此溶液中的溶质有反应生成的氢氧化钠和过量的氢氧化钙;
②实验二中若用氯化钙溶液代替氢氧化钙溶液,所得沉淀碳酸钙的质量取决于碳酸根结合钙离子的质量,与阴离子无关,故质量相等;
(2)设样品中碳酸钠的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x5g
![]() =
=![]() 解:x=5.3g;
解:x=5.3g;
样品的质量为9.3g,而碳酸钠为5.3g,因此还含有氢氧化钠,故是部分变质;
(3)样品的质量为9.3g,而碳酸钠为5.3g,含有氢氧化钠9.3g-5.3g=4.0g
设与氢氧化钠反应的盐酸为y,与碳酸钠反应的盐酸为z,生成二氧化碳为n
Na2CO3+2HCl=2NaCl+H2O+CO2↑;NaOH+HCl=NaCl+H2O
106 7344 8036.5
5.3gz×7.3% n4.0g y×7.3%
![]()
![]() =
=![]()
![]()
解得:z=50g,y=50g,n=2.2g;
由图盐酸优先与氢氧化钠反应,后与碳酸钠反应,所以图示为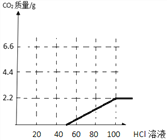 。
。

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】以下事实对应的解释错误的是
序号 | 事实 | 解释 |
A | 在花园中可闻到花香 | 分子在不断运动 |
B | 用肉眼不能直接观察到CO2分子 | CO2分子很小 |
C | 50毫升水与50毫升酒精混合,混合后总体积小于100毫升 | 分子之间有间隔 |
D | 冰受热变为水,水受热变为水蒸气 | 分子可以再分 |