题目内容
图1为实验室常用的实验装置,回答问题:
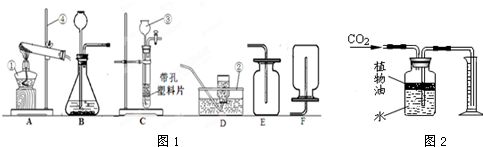
(1)有标号仪器的名称:②______,③______;
(2)用锌和稀硫酸制取氢气,应选用的发生装置是______ (填代号,下同),收集装置是______.若要相同条件下,将相同质量镁、铝、铁分别放入盛有足量稀硫酸的3个烧杯中.反应结束后,生成氢气质量小到大的顺序是______.
(3)装置B、C都可以制取(2)气体,比较这两个装置的不同,指出C装置的一个突出优点______.
(4)加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其化学方程式分别是:
①2NaHCO3══Na2CO3+H2O+CO2↑ ②NH4HCO3══NH3↑+H2O+CO2↑
某同学采用反应①的方法制取CO2,应该选用的发生装置是______,他不选择反应②制取CO2的理由是______.
(5)如图2所示装置可用来测量生成的CO2的体积,其中在水面上放一层植物油的目的是______,植物油上方原有的空气对实验结果______(填“有”或“无”)明显影响.
(6)小张学正在收集一瓶CO2,不知是否收集满了,其验满方法是______.
(7)A装置检查气密性的方法是:把导管的一端浸在水里,用手紧贴试管外壁,若导管口有______,则说明该装置不漏气.
(2)锌和稀硫酸一种固体和一种液体常温下反应;生成氢气的密度小于空气的密度,等质量的镁铝铁和稀硫酸反应生成氢气铝最多,镁其次,铁最少,故答案:C;F;铁、镁、铝.
(3)C有弹簧夹,打开弹簧夹稀硫酸和锌粒就接触反应就发生;关闭止水夹气体就将稀硫酸压入长颈漏斗中,稀硫酸和锌粒分离反应终止,故答案:能控制反应的发生和终止.
(4)固体碳酸氢钠或固体碳酸氢铵加热产生二氧化碳,故答案:A;固体碳酸氢钠或固体碳酸氢铵需加热才能产生二氧化碳.
(5)植物油将二氧化碳和分开,防止二氧化碳溶于水且和水反应;空气中含有二氧化碳,所以植物油上方的空气会对实验结果有影响,故答案:防止二氧化碳溶于水且和水反应影响实验结果;有.
(6)二氧化碳不燃烧也不支持燃烧,所以验满就将燃着的木条放在集气瓶口检验是否收集满,故答案:在集气瓶口放一根燃着的木条.
(7)检验装置气密性先将导管放入水中,然后用手握住试管外壁,若导管口冒出气泡证明气密性良好,故答案:气泡冒出.
分析:(1)根据常见仪器的用途分析.
(2)根据锌和稀硫酸的状态和反应的条件、氢气的密度和镁铝铁和稀硫酸反应生成氢气的化学方程式分析.
(3)根据C有弹簧夹,打开弹簧夹稀硫酸和锌粒就接触反应就发生;关闭止水夹气体就将稀硫酸压入长颈漏斗中,稀硫酸和锌粒分离反应终止分析.
(4)根据反应物的状态和反应条件选择气体的发生装置分析.
(5)根据植物油二氧化碳和分开和二氧化碳能溶于水分析.
(6)根据检验二氧化碳的方法分析.
(7)根据检验装置气密性的方法分析.
点评:此题重在考查同学们对常用化学仪器的了解和识记情况,只有很好的认识它们,做实验才能得心应手.
属于扩展性问题,重在考查根据物质的反应物和反应条件选取装置.该题的难点就是判断等质量的镁、铝、铁与足量的稀硫酸反应生成氢气的多少,计算时金属的质量设个具体的数值就好计算了.

(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
|
金属单质 |
铜 |
铝 |
锌 |
铁 |
铅 |
|
导电性(以银的导电性为100作标准) |
99 |
61 |
27 |
17 |
7.9 |
|
密度/(g·cm-3) |
8.92 |
2.70 |
7.14 |
7.86 |
11.3 |
|
熔点/℃ |
1083 |
660 |
419 |
1535 |
328 |
|
硬度(以金刚石的硬度为10作标准) |
2.5~3 |
2~2.9 |
2.5 |
4~5 |
1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
_________________________________________________________。
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为 ,由此我发现了一条新的判断依据 。
 (4)炼铁的原理是利用一氧化碳与氧
(4)炼铁的原理是利用一氧化碳与氧
化铁反应。在实验室里,可用右图
所示装置进行实验:实验中玻璃管内
的粉末由红色变为 色,该反
应的化学方程式为 ,通过实
验我可以得出的一氧化碳的相关
化学性质是 。
(5)工业上火法炼铜的一个主要反应是 Cu2S
+ O2  2Cu
+ SO2 Cu2S中铜元素的质量分数为_______________
(写出算式)。
2Cu
+ SO2 Cu2S中铜元素的质量分数为_______________
(写出算式)。
用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;在呼吸面具中和潜水艇里常用作供氧剂.
【提出猜想】淡黄色粉末可能是:a.硫; b.过氧化钠; c.硫和过氧化钠的混合物.
【实验探究一】过氧化钠与水反应的生成物是什么?
(1)取适量的该粉末于试管中,加入足量蒸馏水产生气泡,证明猜想______不成立;
(2)用带火星的木条伸入反应的试管中,木条复燃,说明产生______;
(3)充分反应后,试管中只得到无色溶液;向溶液中滴加______,观察到______,证明生成物中有NaOH;同时证明猜想______成立.
(4)写出过氧化钠与水反应的化学方程式:______.
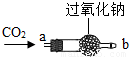
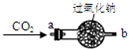
【实践探究二】过氧化钠为什么能作供氧剂?大家讨论认为可能是CO2在常温下能与过氧
化钠反应有关,于是设计如图所示的装置继续实验探究.
| 实 验 操 作 | 实 验 现 象 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的气体通入澄清石灰水中 | 有气泡产生, 石灰水变浑浊 |
【交流比较】与我们学过的用KClO3或KMnO4制取氧气的方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂的主要理由是(从两个不同角度回答):______、______.
 如图是常用的实 验装置图,根据所学知识回答下列问题:
如图是常用的实 验装置图,根据所学知识回答下列问题: