题目内容
(1)经测定某生石灰(CaO)样品中含有25%的碳酸钙,现将此样品在高温下充分煅烧至反应完全反应,所得固体的质量是原样品质量的______%.
(2)某碳酸钙样品中含碳元素的质量分数为6%(假设杂质不含碳元素),则样品中CaCO3的质量分数为______.
解:(1)假设样品质量为100g,则样品中含碳酸钙25g,设碳酸钙完全分解生成氧化钙质量为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
25g x
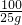 =
=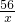 x=14g
x=14g
所得固体的质量是原样品质量的百分比= ×100%=89%
×100%=89%
(2)假设样品质量为100g,则样品中含碳元素质量为6g,则含碳元素6g的碳酸钙的质量=6g÷ ×100%=50g
×100%=50g
则样品中CaCO3的质量分数=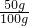 ×100%=50%
×100%=50%
故答案为:(1)89%;(2)50%.
分析:(1)碳酸钙煅烧完全反应后所得固体为氧化钙,因此计算出样品中含有25%的碳酸钙分解出氧化钙的质量或二氧化碳的质量,可解决所得固体的质量是原样品质量的百分比;
(2)由样品中碳元素的质量分数推断出一定量的样品中碳酸钙的质量,从而求得样品中CaCO3的质量分数.
点评:本题涉及化学方程式的计算和化学式的计算,解答时注意区别对待,题目考查基础的计算技能.
CaCO3
 CaO+CO2↑
CaO+CO2↑100 56
25g x
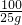 =
=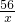 x=14g
x=14g所得固体的质量是原样品质量的百分比=
 ×100%=89%
×100%=89%(2)假设样品质量为100g,则样品中含碳元素质量为6g,则含碳元素6g的碳酸钙的质量=6g÷
 ×100%=50g
×100%=50g则样品中CaCO3的质量分数=
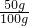 ×100%=50%
×100%=50%故答案为:(1)89%;(2)50%.
分析:(1)碳酸钙煅烧完全反应后所得固体为氧化钙,因此计算出样品中含有25%的碳酸钙分解出氧化钙的质量或二氧化碳的质量,可解决所得固体的质量是原样品质量的百分比;
(2)由样品中碳元素的质量分数推断出一定量的样品中碳酸钙的质量,从而求得样品中CaCO3的质量分数.
点评:本题涉及化学方程式的计算和化学式的计算,解答时注意区别对待,题目考查基础的计算技能.

练习册系列答案
相关题目