题目内容
老师从实验桌上拿出两瓶常用的但标签已经模糊不清的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体.我们对此气体展开了一系列探究:
(1)①此气体是什么物质?验证它的实验方案如下:
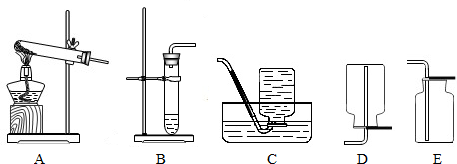
②我想制取该气体,发生装置将选取1图中的
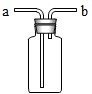
③如果用如图2所示装置收集我猜想的气体,我认为气体应从
(2)100g某硫酸溶液与6.5g锌恰好完全反应,计算该硫酸溶液中溶质的质量分数?
(1)①此气体是什么物质?验证它的实验方案如下:
| 猜 想 | 验证猜想的实验步骤 | 现象及结论 | ||||||||
| 我认为此气体可能是 氧气 氧气 |
带火星的木条插入气体中, 带火星的木条插入气体中, |
木条复燃,是氧气 木条复燃,是氧气 | ||||||||
| 产生此气体的一个化学方程式是 2H2O2
2H2O2
| ||||||||||
B
B
(填序号,以下同),收集装置选取C或E
C或E
.③如果用如图2所示装置收集我猜想的气体,我认为气体应从
a
a
端(填“a”或“b”)导入.(2)100g某硫酸溶液与6.5g锌恰好完全反应,计算该硫酸溶液中溶质的质量分数?

分析:制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;氧气的检验方法是:将带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳用澄清的石灰水检验.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;氢气的检验方法是:点燃,产生蓝色火焰,是氢气.
解答:解:(1)如果用双氧水制氧气就不需要加热,氧气的检验方法是:将带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气;答案为:①氧气,带火星的木条插入气体中,木条复燃,是氧气(或二氧化碳,通入澄清的石灰水,石灰水变浑浊,是二氧化碳或氢气,点燃,产生蓝色火焰,是氢气);2H2O2
2H2O+O2↑或CaCO3+2HCl=CaCl2+H2O+CO2↑或Zn+H2SO4=ZnSO4+H2↑
②如果用双氧水制氧气就不需要加热,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:B;收集装置;氧气C或E、二氧化碳E、氢气C或D
③如图2所示装置收集氧气,我认为气体应从a进入,因为氧气的密度比空气的密度大,故答案为:a;(氧气 二氧化碳从 a进、氢气从b进)
(2)设硫酸溶液中溶质的质量分数为x
Zn+H2SO4=ZnSO4+H2↑
65 98
6.5g 100g.x
=
x=9.8%
答:硫酸溶液中溶质的质量分数是9.8%.
故答案为:9.8%
| ||
②如果用双氧水制氧气就不需要加热,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:B;收集装置;氧气C或E、二氧化碳E、氢气C或D
③如图2所示装置收集氧气,我认为气体应从a进入,因为氧气的密度比空气的密度大,故答案为:a;(氧气 二氧化碳从 a进、氢气从b进)
(2)设硫酸溶液中溶质的质量分数为x
Zn+H2SO4=ZnSO4+H2↑
65 98
6.5g 100g.x
| 65 |
| 98 |
| 6.5g |
| 100g?x |
答:硫酸溶液中溶质的质量分数是9.8%.
故答案为:9.8%
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和根据化学方程式的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关,有关的计算要准确.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
相关题目